学位論文要旨
| No | 114548 | |
| 著者(漢字) | 藤本,晃久 | |
| 著者(英字) | ||
| 著者(カナ) | フジモト,アキヒサ | |
| 標題(和) | マウス卵減数分裂過程におけるMosの役割 | |
| 標題(洋) | ||
| 報告番号 | 114548 | |
| 報告番号 | 甲14548 | |
| 学位授与日 | 1999.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第1468号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 生殖・発達・加齢医学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 配偶子形成過程における減数分裂は、DNAを倍加させた後2回の分裂によってDNAの半数体を生み出すことを特徴とする.有性生殖を行う生物にとっては種の保存に必要不可欠のものであり、その制御には通常の体細胞分裂とは異なった機序が働いていると考えられる.卵子の形成過程においては、胎生期に原始生殖細胞から分化した卵祖細胞は体細胞分裂によって数を増すが、卵母細胞への分化とともに体細胞分裂から減数分裂への移行がはじまる.減数分裂を開始した卵母細胞はDNA合成を行った後、第1分裂前期に至り分裂停止するが、出生を経て思春期に至るまでこのまま長い休止期に至る. 第1減数分裂の前期で停止した卵母細胞がホルモン刺激により分裂停止を解除、一度の分裂を経て第2減数分裂中期に至り、受精可能な状態となって再び分裂停止するまでの過程は卵成熟と呼ばれる(図).第1減数分裂前期の卵母細胞は、卵核胞(germinal vesicle)と呼ばれる大きな核を有する.ホルモン刺激により減数分裂を再開すると、卵核胞は崩壊(germinal vesicle breakdown)し、染色体が凝縮し、やがて紡錘体を形成、第1減数分裂中期(Metaphase I)に至る.その後染色体は二分され、著しい不等分裂によって小さな第1極体を放出する.その後染色体は凝縮したまま核形成、DNA合成を経ることなく再び紡錘体を形成、第2減数分裂中期に至る.ここで分裂は再び停止、精子の侵入により分裂停止は解除され、染色体は二分され第2極体を放出して雌性前核を形成し、減数分裂は終了する. 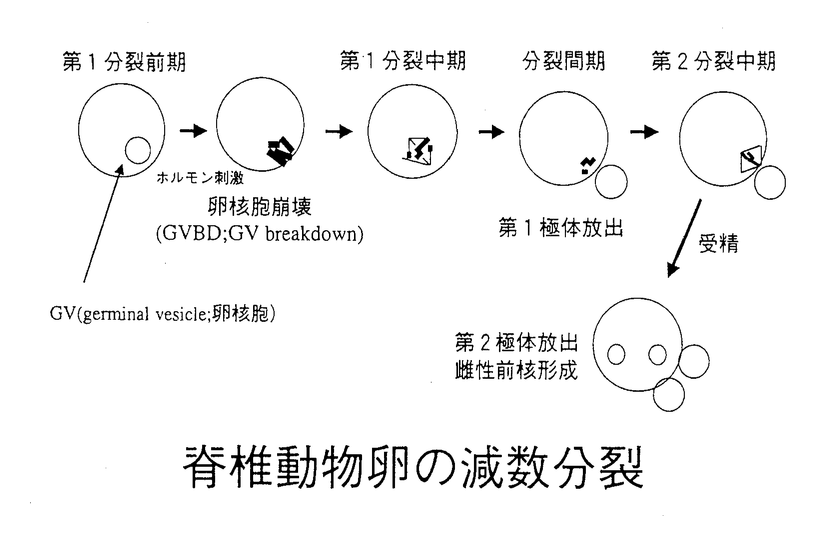 c-mos原癌遺伝子の転写産物であるMosは、分子量39kDのセリン-スレオニンキナーゼ活性を持つタンパクであるが、正常細胞においては脊椎動物の生殖線に特異的に発現していることがわかっている.Mosの機能解析が進むにつれ、このタンパクが脊椎動物の卵成熟に深く関与していることが明らかになってきた.アフリカツメガエルにおいて、Mosはプロゲステロンの作用により合成され、卵成熟の開始(卵核胞崩壊)、減数分裂間期におけるDNA合成の阻害および第2分裂への移行、そして第2分裂中期における分裂停止に関与し、受精後には速やかに分解される.マウスにおいては、Mosはカエルの場合と異なり減数分裂開始には必須のタンパクではなく、第2分裂中期における分裂停止に必須であることがこれまでに明らかにされた.しかし、減数分裂間期におけるMosの役割に関しては厳密な検討がなされておらず、一定の見解が得られていない.ここでは、Mosの減数分裂間期における役割を明確にするために、c-mosホモ欠損マウス卵、およびヘテロ欠損マウス卵を用いて体外培養を行い、1時間ごとに第1極体放出を観察、極体放出から1時間以内の卵母細胞を同定することにより、減数分裂間期の進行をシンクロナイズさせた.第1極体放出後の時間を一致させてサンプリングした卵の染色体の変化、および各種cell cycle regulatorの変化を検討した. まず、第1極体放出後の卵母細胞を免疫染色し、蛍光顕微鏡で観察したところ、ヘテロ卵を第1極体放出直後にサンプリングし、DAPI染色を行ったものでは、凝縮した染色体の集合体が認められた.1時間後には、染色体は凝縮したままの状態であり、さらに第1極体放出2時間後では染色体は赤道面上に並び、紡錘体形成が認められた.一方ホモ卵の核相の進行を同様に追跡したところ、第1極体放出1時間後、ホモ卵においてのみ、染色体が集合し、核様の構造をとっていることが観察された.次に、この一時的に認められた核様構造が染色体脱凝縮によるものか否かを検討するため、第1極体放出1時間後の卵を低張溶液で処理し、DAPI染色により染色し、観察した.ヘテロ卵では、個々に分離した染色体が観察されたが、ホモ卵のDNAは一塊となり、染色体構造は認められなかった.これはこの核様の構造体が、単に染色体が凝集したものではなく、染色体の構造変化の結果生じたことを示唆している.このことより、ホモ卵においては、減数分裂間期に一時的に染色体脱凝縮を生じることが示唆された. 減数分裂間期のホモ卵に見られた脱凝縮状態は、正常な核形成とどのような関連性があるのかを確かめるため、次に我々は、第1極体放出後の卵を、タンパク合成阻害剤であるcycloheximideを用いて処理し、染色体構造の変化を観察した.ヘテロ卵に、第1極体放出1時間後よりcycloheximide処理を行った場合、染色体は凝縮したまま、第2分裂中期へと移行し、処理開始6時間後においても、第2分裂中期に停止したままであった.一方、ホモ卵を、先の実験において脱凝縮の起きていた、第1極体放出1時間後よりcycloheximide処理した場合、染色体は再凝縮することなく、明瞭な核小体を持つ核を形成した.このことより、極体放出1時間後のホモ卵にみられた染色体の脱凝縮は、正常な核形成の初期段階であることが示唆された. cdc2 kinaseはMPF(M-phase promoting factor)の本体であり、細胞分裂M期における染色体の凝縮を制御すると考えられている.マウス卵成熟においては、cdc2 kinaseは第1分裂中期ならびに第2分裂中期において高い活性を示し、減数分裂間期に活性が低下することが報告されている.われわれは、c-mosホモ欠損マウス卵の減数分裂間期における脱凝縮が、第1極体放出後のcdc2 kinaseの再活性化の制御と何らかの関連を持つ可能性があると考え、再活性化の過程を詳細に調べた.第1極体放出時のcdc2 kinase活性はホモ卵、ヘテロ卵ともに著しく低下していた.ヘテロ卵においては、第1極体放出1時間後にはcdc2 kinase活性は2倍近く上昇し、次の1時間にさらに約2倍になった.一方、ホモ卵では第1極体放出1時間後にもcdc2 kinase活性の上昇は認められず、第1極体放出後2時間で約1.5倍程度上昇するにとどまった.この再活性化の遅れは、染色体脱凝縮の時期に一致していた.すなわち、Mosは減数分裂間期において、低下したcdc2 kimaseの迅速な再活性化を介して染色体凝縮の維持に重要な役割を果たしていることが示唆された. 次に、先に示した、Mosとcdc2 kinaseとの関係をより詳細に検討するため、cdc2 kinaseの個々の構成成分の量的、質的変化を調べた.cdc2 kinaseは、p34cdc2とcyclinBの2つのタンパクの複合体であり、さらにp34cdc2には、活性を制御するリン酸化部位が3個存在することがこれまでに知られている.このうち、161-Thrに関しては、p34cdc2の161-Thrのリン酸化を特異的に検出するポリクローナル抗体を用いて検討した.ヘテロ卵においては、第1極体放出時にはcyclinBはほとんど検出されない.しかし、第1極体放出1時間後にはcyclinBの著明な増加が認められ、次の1時間でさらに増加した.また、p34cdc2の総量、および電気泳動の移動度には明らかな変化はなく、161-Thrのリン酸化レベルも変化しなかった.一方ホモ卵においては、第1極体放出直後のcyclinBは、やはりほとんど検出されなかった.極体放出1時間後、cyclinBはごくわずかしか増加せず、次の2時間後にはやや増加したものの、ヘテロ卵に比べ、蓄積量は明らかに低下していた.また、p34cdc2の総量には変化は認められなかったものの、161-Thrのリン酸化は、第1極体放出直後および1時間後において、若干低下していた.すなわち、ホモ卵の減数分裂間期における染色体脱凝縮は、主としてcyclinBの蓄積の遅れによる、cdc2 kinaseの再活性化の遅れが原因となっていることが強く示唆された.従ってMosは、マウス減数分裂間期において、cyclinBの蓄積を通して、染色体凝縮の維持に関与しているものと考えられる. 分裂間期における染色体凝縮の維持はどのような意味を持つのであろうか.これまでの報告や我々の予備実験よりは、減数分裂間期の一時的な染色体脱凝縮は、核膜の形成やDNA合成の開始には不十分な核形成の初期に過ぎないことが示唆される.c-mos欠損卵において、異所的なDNA複製や光学顕微鏡レベルでの染色体異常は生じていないが、この時期に染色体の再編成や他の変化が起きている可能性は残されている.このことが、c-mos欠損卵のうち30%が単為発生を起こさず、第2分裂中期にとどまっているにもかかわらず、妊孕性が著しく低い原因なのかもしれない.第2分裂中期に停止したc-mos欠損卵の染色体構造を詳細に分析することでMosの卵減数分裂間期における染色体凝縮維持の生物学的意義が明らかになるかもしれない. | |
| 審査要旨 | 近年不妊治療における体外受精・顕微授精の普及と共に、臨床領域においてヒトの配偶子をin vitroで操作することが可能となってきた.その一方で配偶子形成過程・受精・胚発育・着床といったさまざまな場面における障害が不妊症の原因となりうることが明らかになりつつあり、これらの解決の糸口となるべき基礎的・臨床的分野での研究が注目を集めている. 本研究は、マウス卵母細胞の減数分裂過程の分子レベルでの制御機構に着目、Mosタンパクの関与につき検討しており、以下の結果を得ている. 1.c-mosホモ欠損マウス卵の第1極体放出後の分裂像の変化を免疫染色で追ったところ、Mosを有する卵とは異なり、第1極体放出1時間後では一時的に卵母細胞中の染色体が脱凝縮しており、それらは低張処理を施しても分離しないことを示した.従ってMosはマウス卵減数分裂中の染色体凝縮の維持に関与していることが示唆された. 2.同じ時期において、cycloheximide処理を行いタンパク合成を阻害したところ、コントロール卵では染色体は凝縮したままであったが、c-mos欠損マウス卵では速やかに核形成を行うに至った.従ってこの一時的な染色体の脱凝縮は、核形成の前段階であることが示唆された. 3.減数分裂進行中の制御因子の1つとされるcdc2 kinaseについて、第1極体放出後の活性変化をin vitro kinase assaayで検討したところ、c-mos欠損マウス卵において、再活性化が遅れていることが明らかになった.従ってMosは第1極体放出後のcdc2 kinase活性化に関与することが示された. 4.さらにcdc2 kinaseの構成成分の量およびリン酸化レベルをWestern blottingで解析したところ、cdc2 kinaseの再活性化の遅れは、主としてcyclinBの合成の遅れによるものであることが示された. Mosはこれまで、カエル卵母細胞の減数分裂との関係についてはかなり解明されていたが、マウスにおいては異なる役割を果たしていることも示されるなど、その作用には不明な点が多かった.また、Mosは哺乳類において、マウスのみならずヒトやブタなどの卵母細胞の減数分裂についても何らかの役割を果たしていることが示されつつあり、ヒト不妊症との関係も注目されている.本研究は、哺乳類卵母細胞減数分裂機構の解明に端緒を与えるものであり、学位の授与に値するものと考えられる. | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54716 |