細胞接着分子のintegrinは細胞膜貫通型の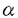 鎖 鎖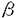 鎖よりなるheterodimerの受容体である。integrinはinside-outのシグナル伝達によりコンフォーメーションが変化し、活性化され、細胞の接着や分化を制御する。特に、血小板表面上のintegrin 鎖よりなるheterodimerの受容体である。integrinはinside-outのシグナル伝達によりコンフォーメーションが変化し、活性化され、細胞の接着や分化を制御する。特に、血小板表面上のintegrin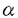 2 2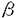 1はコラーゲンと接着しintegrin 1はコラーゲンと接着しintegrin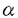 IIb IIb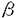 3を活性化する。また、活性化したintegrin 3を活性化する。また、活性化したintegrin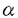 IIb IIb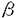 3はfibrinogenと接着し血小板同士の凝集に関わっている。 3はfibrinogenと接着し血小板同士の凝集に関わっている。 さて、H-Rasとintegrin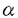 IIb IIb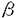 3をCHO細胞(Chinese Hamster Ovary Cell)にトランスフェクションし、integrin 3をCHO細胞(Chinese Hamster Ovary Cell)にトランスフェクションし、integrin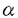 IIb IIb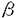 3の活性化を調べた報告から、H-Rasがintegrin 3の活性化を調べた報告から、H-Rasがintegrin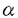 IIb IIb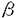 3の活性化を抑制していることが明らかとなった。この抑制メカニズムには、転写は関係しておらず、無核細胞である血小板でも存在する系と考えられた。しかし、生体の血小板でのH-Rasの役割については試験管内での実験結果からだけでは明らかでない。そこで、私は、H-Ras過剰発現マウスとH-Ras欠損マウスの血小板を用いて、ADPおよびコラーゲンをagonistとして加え、比濁法により血小板凝集能を測定した。その結果、ADPによる1次凝集はH-Ras欠損マウスとH-Ras過剰発現マウスおよび野生型マウスで著明な差を認めなかった。コラーゲンによる2次凝集はH-Ras過剰発現マウスでは著明に抑制され、H-Ras欠損マウスでは若干亢進していた。また、ADPによる凝集曲線の形より2次凝集に相当すると思われる部分はH-Ras過剰発現マウスで抑制、H-Ras欠損マウスで亢進している傾向が見られた。 3の活性化を抑制していることが明らかとなった。この抑制メカニズムには、転写は関係しておらず、無核細胞である血小板でも存在する系と考えられた。しかし、生体の血小板でのH-Rasの役割については試験管内での実験結果からだけでは明らかでない。そこで、私は、H-Ras過剰発現マウスとH-Ras欠損マウスの血小板を用いて、ADPおよびコラーゲンをagonistとして加え、比濁法により血小板凝集能を測定した。その結果、ADPによる1次凝集はH-Ras欠損マウスとH-Ras過剰発現マウスおよび野生型マウスで著明な差を認めなかった。コラーゲンによる2次凝集はH-Ras過剰発現マウスでは著明に抑制され、H-Ras欠損マウスでは若干亢進していた。また、ADPによる凝集曲線の形より2次凝集に相当すると思われる部分はH-Ras過剰発現マウスで抑制、H-Ras欠損マウスで亢進している傾向が見られた。 以上より、H-Rasは血小板2次凝集を抑制し、その結果、血小板凝集能も抑制することが示された。 さて、H-Rasが血小板の2次凝集を抑制するメカニズムは明らかではないが、H-Rasが血小板膜上のintegrinの発現を制御していて、受容体数が減少しているため、血小板凝集能が抑制されている可能性も否定できない。この可能性を検討するため、flowcytometry解析により、野生型およびH-Ras過剰発現マウス、H-Ras欠損マウスの血小板上のintegrinの発現を調べた。その結果、integrin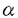 2 2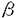 1の発現はH-Ras過剰発現マウスでもH-Ras欠損マウスでも有意な変化を認めなかった。ただし、H-Ras欠損マウスで2相性である可能性は否定できない。また、integrin 1の発現はH-Ras過剰発現マウスでもH-Ras欠損マウスでも有意な変化を認めなかった。ただし、H-Ras欠損マウスで2相性である可能性は否定できない。また、integrin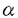 IIb IIb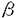 3はH-Ras欠損マウスでは有意な変化を認めなかったが、H-Ras過剰発現マウスで野生型マウスの約2倍の発現量を認めた。発現量が増加すれば、凝集能は亢進すると考えられるが、血小板凝集能の結果から、凝集は低下しており、従って、H-Rasはシグナル伝達を通じて、血小板凝集能を抑制していると結論した。 3はH-Ras欠損マウスでは有意な変化を認めなかったが、H-Ras過剰発現マウスで野生型マウスの約2倍の発現量を認めた。発現量が増加すれば、凝集能は亢進すると考えられるが、血小板凝集能の結果から、凝集は低下しており、従って、H-Rasはシグナル伝達を通じて、血小板凝集能を抑制していると結論した。 H-Rasがintegrinを抑制する機構はまだ解明されていない。血小板でもH-Rasがintegrinを抑制することは、血小板を抑制するとされるPDGF、NOの下流にH-Rasがあることと一致する。また、PDGFやNOと同様の抑制作用が知られているProstaglandin E1のシグナルの下流の分子であるか、もしくは、下流の分子を抑制している可能性も考えられる。また、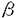 3-endonexinやCD98の発現を制御することにより、integrin 3-endonexinやCD98の発現を制御することにより、integrin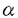 IIb IIb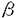 3を抑制している可能性も考えられる。また、 3を抑制している可能性も考えられる。また、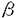 3の過剰発現によりintegrin 3の過剰発現によりintegrin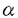 v v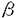 3を抑制する観察も報告されており、同様の機構が血小板にも存在する可能性もある。血小板凝集の生体内では止血と傷害の修復に大きな役割を果たしている。そこで、生体内でH-Rasが血小板凝集能抑制を通して果たす役割を、bleomycin肺損傷の修復の系を用いて検討した。bleomycin肺傷害後の線維化病変の形成を具体的に述べる。傷害部位で露出した細胞外マトリックスであるコラーゲンにより活性化した血小板は凝集し、PDGF、IGF、TGF 3を抑制する観察も報告されており、同様の機構が血小板にも存在する可能性もある。血小板凝集の生体内では止血と傷害の修復に大きな役割を果たしている。そこで、生体内でH-Rasが血小板凝集能抑制を通して果たす役割を、bleomycin肺損傷の修復の系を用いて検討した。bleomycin肺傷害後の線維化病変の形成を具体的に述べる。傷害部位で露出した細胞外マトリックスであるコラーゲンにより活性化した血小板は凝集し、PDGF、IGF、TGF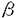 などのchemoattractantsを放出し、macrophageをはじめとする炎症細胞が遊走・集積を始める。そして、さらにautocrine的にchemoattractantsを放出し、さらに細胞遊走と集積とを引き起こすとともに、線維芽細胞がコラーゲンを生産する。こうして、沈着したコラーゲンが肺線維化病変となる。 などのchemoattractantsを放出し、macrophageをはじめとする炎症細胞が遊走・集積を始める。そして、さらにautocrine的にchemoattractantsを放出し、さらに細胞遊走と集積とを引き起こすとともに、線維芽細胞がコラーゲンを生産する。こうして、沈着したコラーゲンが肺線維化病変となる。 このように血小板凝集が傷害の治癒とremodelingの最初に起きる反応であるならば、H-Rasは血小板凝集を抑制するため、傷害のremodelingをも抑制すると考えられた。そこで、H-Ras過剰発現マウスとH-Ras欠損マウスを用いて、bleomycin肺傷害とその線維化病変について検討した。bleomycinを10日間連続投与して、第7日目にmacrophageの集積を、また、第14日目に線維化病変の形成を調べた。その結果、H-Ras欠損マウスと野生型マウスでは、第7日目のmacrophage集積は約2倍に増加しており、第14日目の線維化病変も形成していたが、H-Ras過剰発現マウスでは、第7日目のmacrophageの集積も、第14日目の線維化病変も認めなかった。 H-Ras欠損マウスとその野生型マウスを比較して、線維化病変に有意な差がなかったのは、体内の生理学的濃度では、血小板凝集能に著明な差が出なかったためと考えられた。また、H-Ras欠損マウスとその野生型マウスがC57BL/6Jと129/SvJとの交雑系統であることも理由と考えられた。 以上の実験から、H-Rasは血小板凝集を抑制し、さらに、bleomycin肺傷害の線維化病変の形成も抑制することが示された。 さて、H-Ras過剰発現マウスは血管肉腫を高率に発症し、その際、多量の腹腔内出血を認め、血小板凝集能低下が病態に関与していることが予想された。また、beige mouseはdense granule欠損により、血小板凝集能が低下するが、bleomycin肺傷害による線維化病変が生じやすいことが報告されている。これは、2次凝集が抑制されているH-Ras過剰発現マウスと原理的に1次凝集が抑制されているbeige mouseとの差と考えられた。ヒトの疾患であるGray Platelet Syndromeは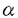 -granule欠損により本来 -granule欠損により本来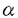 -granulc内に貯蔵されているべきPDGFとTGF -granulc内に貯蔵されているべきPDGFとTGF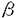 が放出され、骨髄の線維化等が認められるが、H-Ras過剰発現マウスでは認めない。H-Ras過剰発現マウスでは が放出され、骨髄の線維化等が認められるが、H-Ras過剰発現マウスでは認めない。H-Ras過剰発現マウスでは -granuleの放出も含めた血小板2次凝集能の抑制が起こっていると考えられた。 -granuleの放出も含めた血小板2次凝集能の抑制が起こっていると考えられた。 これまで、生体の実験系では、癌遺伝子として知られてきたH-Rasが本研究では、血小板凝集能低下を通じて、治癒の方向に働くことが示された。この事実から、特発性肺線維症の病態の解明、治療法の開発に大きく寄与すると予想された。また、血小板凝集・傷害とremodelingの実験でH-Rasの転写を介さない新しい生体機能の存在が示唆された。 |