方法と結果 1.IRF-1,p53両欠損マウスにおける腫瘍発生の促進
はじめに、野生型、IRF-1欠損、p53欠損、IRF-1,p53両欠損マウスの、生後200日以内での腫瘍の自然発生率を比較した。野生型マウスでの腫瘍発生はなく、IRF-1欠損マウスでは、2%に悪性線維性組織球腫が特徴的に認められた。これに対して、p53欠損マウスでは56%に腫瘍の発生をみたが、IRF-1,p53両欠損マウスでは、96%が腫瘍により死亡した(図1)。
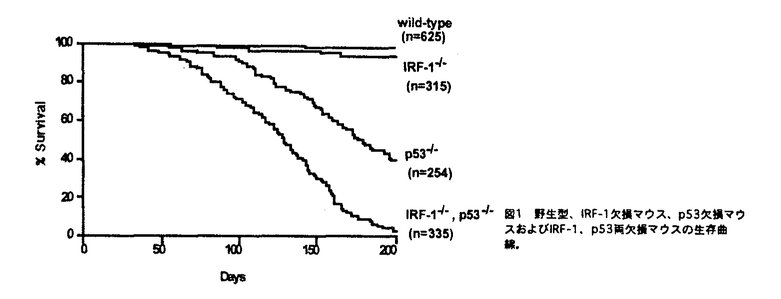 図1野生型、IRF-1欠損マウス、p53欠損マウスおよびIRF-1、p53両欠損マウスの生存曲線。
図1野生型、IRF-1欠損マウス、p53欠損マウスおよびIRF-1、p53両欠損マウスの生存曲線。 次に、IRF-1,p53両欠損マウスの腫瘍の特徴をp53欠損マウスと比較した。1個体に複数の腫瘍が発生する頻度は、p53欠損マウスで7%であるのに対して、IRF-1,p53両欠損マウスでは49%であった。さらに組織学的には、p53欠損マウスでは胸腺リンパ腫が過半数を占めるのに対して、IRF-1,p53両欠損マウスでは全身性リンパ腫、血管肉腫、精巣奇形腫など種々の肉腫もしばしば認められ、神経節神経芽腫なども認められた。
2.免疫学的異常による影響について(発生工学的アプローチ)
IRF-1欠損マウスでは、ナチュラルキラー(NK)細胞が消失していることが知られている。NK細胞は腫瘍免疫に重要な役割を果たしており、この効果がp53欠損マウスでの腫瘍発生の表現型を強調している可能性も残されている。受精卵凝集法により作製したIRF-1,p53両欠損←→p53欠損キメラマウスを用いれば、免疫系などの環境をそろえて、体を構成するIRF-1,p53両欠損細胞とp53欠損細胞のどちらがより癌化しやすいかを検討することが可能である。この方法で作製したマウスでは、2種類の細胞が各臓器でキメラの状態となっていたが、発生した腫瘍の遺伝子型の検索では、IRF-1,p53両欠損の腫瘍の方がp53欠損の腫瘍よりも数が多かった。従って、p53欠損細胞に比べて、IRF-1,p53両欠損細胞はそれ自身でより癌化しやすい性質を獲得していることが示された。
3.IRF-1,p53欠損細胞が示す種々の異常
次に細胞レベルでは、IRF-1,p53が両方欠損することで、以下のような癌化につながる異常が生じていることが見出された。
3-1.遺伝子変異率の上昇
遺伝子の変異率を、ウワバイン耐性コロニー数によって野生型、IRF-1欠損、p53欠損、およびIRF-1,p53両欠損EFで検討した。シスプラチン処理をおこなった場合、野生型、IRF-1欠損EFではコロニーの出現をみないが、p53欠損EFでは、105細胞あたり平均4.8個のウワバイン耐性コロニーが出現した。これに対してIRF-1,p53両欠損EFでは、コロニー数は平均20.2個に増加していた。MNNGで処理した場合、野生型、IRF-1欠損EFではコロニーは出現せず、p53欠損EFでは、105細胞あたり平均0.3個、IRF-1,p53両欠損EFでは平均15.8個のウワバイン耐性コロニーが出現した。
3-2.細胞増殖の異常
脾臓リンパ球、およびEFの増殖について検討を行った。脾臓リンパ球をコンカナバリンAで刺激した場合、野生型とp53欠損リンパ球では同程度の増殖能を示したが、IRF-1欠損リンパ球では、刺激後1週間にわたって増殖の亢進が持続していた。さらにIRF-1,p53を両方欠損したリンパ球はより亢進した増殖能を示した。一方、EFでは、野生型とIRF-1欠損EFの増殖曲線はほぼ同様のパターンを示した。これに対して、p53欠損EFは、より速やかな増殖をしめし、細胞飽和密度も上昇していた。さらにIRF-1,p53両欠損EFは、対数増殖期での増殖速度はp53欠損EFと同程度であるが、最終的な細胞飽和密度は、p53欠損EFに比してさらに上昇していた。
4.転写因子IRF-1,p53の共通の標的の検索
3.で示された結果をふまえ、このような細胞レベルでの異常を引き起こす因子がIRF-1,p53の共通の標的である可能性があると考え、DNA修復や細胞周期を制御する因子の発現を検討した。
まずシスプラチンによる変異率の上昇からは、IRF-1,p53両欠損細胞におけるヌクレオチド除去修復の不全が示唆されるので、これに関与する既知の因子の発現を各遺伝子型のEFで比較したが、特に発現に差のあるものはなかった。またMNNGによる変異率の上昇からは、O6-メチルグアニンDNAメチルトランスフェラーゼ(MGMT)、あるいはメチルプリンDNAグリコシラーゼ(MPG)などの塩基除去修復の機能不全が示唆されるので、これらの遺伝子発現を各遺伝子型のEFで比較した。MPGは各EFで同程度に発現しており、一方、MGMTの発現、誘導はp53に依存するが、IRF-1欠損による影響は認められなかった。
細胞増殖の亢進からは、細胞周期を調節する因子の発現異常が疑われた。そこで各サイクリンD,E、Rb、cdk2,4,6およびサイクリン依存性キナーゼ抑制因子p16INK4a、p19INK4d、p19ARF、p27などの発現を各遺伝子型のEFで検討したが、IRF-1の欠損に伴って、特に発現量に差が生じているものはなかった。