| [序] ストリキナスアルカロイドはストリキニーネ(1)、ツビフォリジン(2)などに代表されるモノテルペン系インドールアルカロイドである(Figure1)。これらのアルカロイドは、その生理活性ならびに複雑な構造から合成化学的に注目されており、ラセミ体の合成は古くから盛んに行なわれている。また近年、光学活性体の合成例も1と2などを中心にいくつか報告されている。これらの報告は、含窒素複素環化合物の骨格構築法、それにともなう新規反応の開発という観点から見れば、いずれも興味深い合成例である。しかし、化学触媒を用いる効率的な触媒的不斉合成には未だ至っていない。そこで私は、当研究室で開発された多機能複合金属不斉錯体AlLibis((R)-binaphthoxide)((R)-ALB)を用いるマイケル反応を鍵工程として、ストリキナスアルカロイドの実践的触媒的不斉全合成研究を行なうべく本研究に着手した。  Figure 1[触媒的不斉マイケル反応の最適化] Figure 1[触媒的不斉マイケル反応の最適化] 合成に先立ち、鍵工程となるシクロヘキセノン(3)とマロネートとの触媒的不斉マイケル反応の最適化を行なうことにした(Table1)。なおマロネートは、合成的有用性を重視して、後に脱炭酸等官能基変換の容易なメチルマロネート(4)を用いることとした。通常、本反応は0.9等量の塩基を加えたALB錯体5mol%を用いる必要がある(run1)。そこで、触媒活性をさらに向上させるべく種々検討した。その結果、触媒としてALB-KO-t-Buを用いたところ触媒量0.3mol%でも反応は進行したが、88%eeと若干の光学収率の低下がみられた(run2)。これは、系中に存在する微量の水のために徐々に触媒が失活していることが原因だと推察された。そこでこれを取り除く目的で、活性化したモレキュラーシーブス4A(MS4A)を加えたところ、触媒量0.3mol%でも化学収率94%、光学収率99%eeと優れた触媒活性を保持することを見い出した(run3)。さらに、本反応は100gスケールでも行ない、大量合成にも十分適応可能であった(run4)。室温、無害、低コスド(ビナフトールは容易に回収できる)、再結晶により精製可能といった特徴と併せて、本反応は将来医薬を初めとする有用な光学活性化合物を工業的スケールで合成する際にも、十分応用しうるものと期待している。 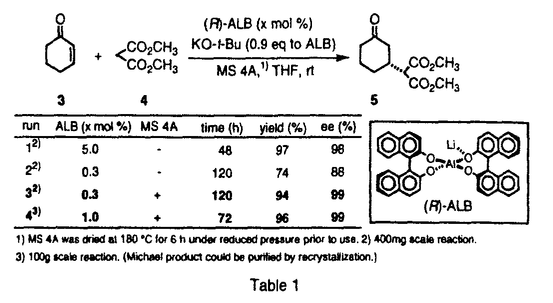 Table 1[20-デエチルツビフォリジン(6)の触媒的不斉合成] Table 1[20-デエチルツビフォリジン(6)の触媒的不斉合成] まず、一般的なストリキナスアルカロイドの合成法を確立するために、基本骨格を有するモデル化合物20-デエチルツビフォリジン(6)を最初のターゲットに設定した(Scheme1)。その合成戦略は、鍵工程である上記の触媒的不斉マイケル反応によって、E環の構築を行なうというものである。続いて、マイケル成績体(5)に対して位置選択的なフィッシャーのインドール環構築反応、脱炭酸を行ない、ストリキナスアルカロイドのA、B、E環部分にあたるエステル(7)を光学活性体として合成した。次に、アルカリ加水分解、アミド化、ボラン還元を経て、アミン体(8)へと変換した。さらにE環部分に有する不斉炭素を足掛りとして、順次D環、C環の閉環反応を行ない、6へと導いた。  Scheme 1 Scheme 1 このうちD環の構築は、もうひとつの鍵工程となるDDQを用いる閉環反応によって行なった。一般に、DDQは水の存在下脱水素中間体を経てインドール体の 位を酸化することが知られている。そこで、無水条件下鎖状アミン(8)にDDQを作用すれば、同様の脱水素中間体を経て分子内閉環反応が進行するものと推察した。実際に、種々検討の結果、緩衝剤としてNa2HPO4存在下、脱気したTHF中、低温にてDDQをゆっくり加えたところ、77%という良好な収率で閉環体(9)を得ることに成功した。最後にアセタール交換後、Boschらの手法に準じてソフトな酸であるDMTSFを用いるC環閉環反応、Raney Niを用いる接触還元により、6の初の触媒的不斉合成を達成した。 位を酸化することが知られている。そこで、無水条件下鎖状アミン(8)にDDQを作用すれば、同様の脱水素中間体を経て分子内閉環反応が進行するものと推察した。実際に、種々検討の結果、緩衝剤としてNa2HPO4存在下、脱気したTHF中、低温にてDDQをゆっくり加えたところ、77%という良好な収率で閉環体(9)を得ることに成功した。最後にアセタール交換後、Boschらの手法に準じてソフトな酸であるDMTSFを用いるC環閉環反応、Raney Niを用いる接触還元により、6の初の触媒的不斉合成を達成した。 [ツビフォリジン(2)の触媒的不斉合成] 次に、上記のDDQを用いるD環閉環反応を鍵工程として天然物である2の全合成研究を行なった。そこで20位にエチル基、エチニル基を導入した基質をそれぞれ5から合成し、閉環反応を試みた(Scheme2)。その結果、エチル基のない場合、77%の収率で進行した条件下、エチル基をもつアミンを基質として用いた場合、室温まで昇温しても目的の閉環体(11)は得られなかった。これはエチル基の立体障害によるものと考えている。これを改善すべく、立体障害の少ないエチニル基をもつアミンを基質として試みたところ、収率52%、変換収率67%にて、閉環体(12)を得ることに成功した。また興味深いことに、アミン体にくらべて反応性の低いアミド体では、室温まで昇温しても閉環体(13)を得られないのに対して、不飽和アミドでは、約40%の収率で閉環体(14)を得た。この反応性の違いは、アミド部分の窒素原子上の電子密度に依存しているものと考えている。  Scheme 2 Scheme 2 以上の結果から、12を鍵中間体として2の不斉合成を行なった(Scheme3)。閉環基質の前駆体となる15は5から7工程で合成したアルデヒド(16)とアミン(10)との還元的アミノ化反応等を経て合成した。この還元的アミノ化反応は、ワンポットでTi(O-i-Pr)4とNaBH4を作用させることで、オレフィン部分の過還元等を伴うことなくほぼ定量的に進行した。次に、Boc基を除去した後、前述のDDQを用いるD環閉環反応を行なった。続いて、Wilkinson触媒を用いる立体選択的接触還元、DMTSFを用いるC環閉環反応等を経て、2の初の触媒的不斉合成を達成した。 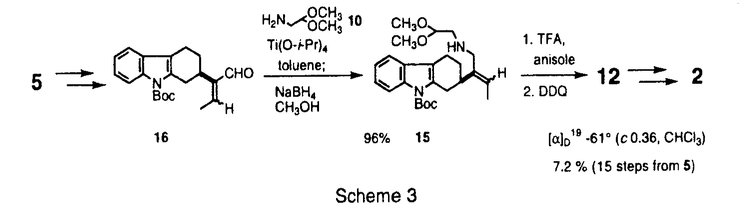 Scheme 3[ストリキニーネ(1)の触媒的不斉合成研究] Scheme 3[ストリキニーネ(1)の触媒的不斉合成研究] 次に、より汎用性の高いストリキナスアルカロイドの合成ルートを構築すべく、別法によるストリキニーネ(1)の触媒的不斉合成研究を行なった。その合成戦略は、18-ヒドロキシアクアマイシン(17)からヴィランド-グムリッヒアルデヒド(18)を経由して1へと導くというものである(Scheme4)。また、17は、鍵工程となる非修飾ケトン(21)の位置選択的 -アリール化反応を行なった後、順次D環、C環ならびにB環を閉環して合成することを計画した。このうち、アリール化反応の基質となる21は、5からアルドール反応、還元的アミノ化反応等11工程を経て合成した。 -アリール化反応を行なった後、順次D環、C環ならびにB環を閉環して合成することを計画した。このうち、アリール化反応の基質となる21は、5からアルドール反応、還元的アミノ化反応等11工程を経て合成した。 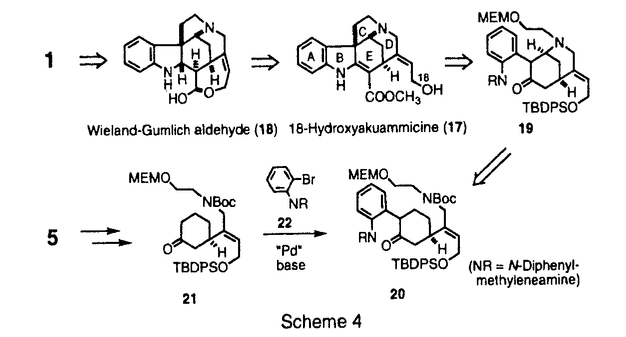 Scheme 4 Scheme 4 続いて、鍵工程となるケトンの -アリール化反応は、NaO-t-Bu存在下Pd2(dba)3-Tol-BINAP錯体を触媒として用いるBuchwaldの手法を用いることにした。まず合成に先立ち、オルト位置換アリールプロミド(22)とベータ置換ケトンとの反応性を調べる目的で、3-Methylcyclohexanone(23)を基質としてモデル反応を行なった(Table2)。その結果、ケトン4等量、NaO-t-Bu2.6等量を用いた場合、収率約40%位置選択性10:1と、2,5-ジ置換ケトン(24)が選択的に得られることを見いだした(run1)。さらにNaO-t-Bu4.4等量用いた場合、位置選択性は5:1とやや減少するものの、カップリング体の収率は約80%に向上した(run2)。 -アリール化反応は、NaO-t-Bu存在下Pd2(dba)3-Tol-BINAP錯体を触媒として用いるBuchwaldの手法を用いることにした。まず合成に先立ち、オルト位置換アリールプロミド(22)とベータ置換ケトンとの反応性を調べる目的で、3-Methylcyclohexanone(23)を基質としてモデル反応を行なった(Table2)。その結果、ケトン4等量、NaO-t-Bu2.6等量を用いた場合、収率約40%位置選択性10:1と、2,5-ジ置換ケトン(24)が選択的に得られることを見いだした(run1)。さらにNaO-t-Bu4.4等量用いた場合、位置選択性は5:1とやや減少するものの、カップリング体の収率は約80%に向上した(run2)。 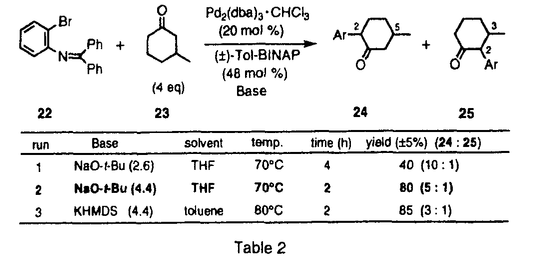 Table 2 Table 2 実際の全合成研究は、以下のように行なった(Scheme5)。鍵工程となる位置選択的 -アリール化反応はTable2で最適化した条件によって行ない、約60%の収率でカップリング体(20)を得た(Scheme36)。なお、過剰に用いたケトン(21)は、ある程度回収可能である。続いて、位置選択的にフェニルセレニル化、過酸で処理することによりエノン体(26)に導いた。さらに、TFAを用いてBoc基を除去したところ、アルカリ条件の後処理によって生じたアミンからのマイケル反応が進行したと思われる、おそらく閉環体(19)と考えられる化合物を得た。今後は、さらに閉環反応等官能基変換を行ない1へと導く予定である。 -アリール化反応はTable2で最適化した条件によって行ない、約60%の収率でカップリング体(20)を得た(Scheme36)。なお、過剰に用いたケトン(21)は、ある程度回収可能である。続いて、位置選択的にフェニルセレニル化、過酸で処理することによりエノン体(26)に導いた。さらに、TFAを用いてBoc基を除去したところ、アルカリ条件の後処理によって生じたアミンからのマイケル反応が進行したと思われる、おそらく閉環体(19)と考えられる化合物を得た。今後は、さらに閉環反応等官能基変換を行ない1へと導く予定である。 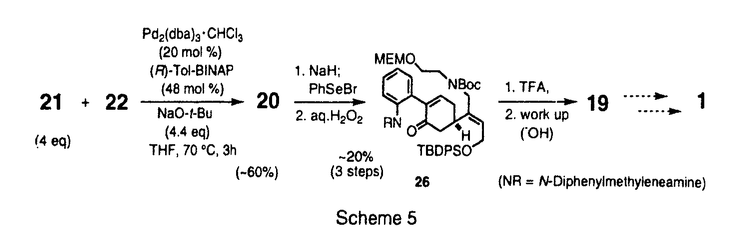 Scheme 5[結語] Scheme 5[結語] 1)シクロヘキセノン(3)とメチルマロネート(4)との触媒的不斉マイケル反応において、ALB-KO-t-Bu-MS4Aの系が最も良好であることを見いだし、わずか触媒量0.3mol%でほぼ定量的かつ完璧なエナンチオ選択性でマイケル成績体(5)を合成した。また100gスケールで反応を行ない、工業化の可能性を示唆する知見を得た。 2)5を用いて、DDQを用いた効率的なD環閉環反応を鍵工程とする20-デエチルツビフォリジン(6)ならびにツビフォリジン(2)の触媒的不斉合成に初めて成功した。 3)5を用いて、ストリキニーネ(1)の触媒的不斉合成研究を行ない、もう一つの鍵工程として、Pd触媒を用いる -置換ケトンの直接的位置選択的 -置換ケトンの直接的位置選択的 -アリール化反応を実現した。 -アリール化反応を実現した。 |