現在、医薬品を構成する生理活性物質は、光学的に純粋な有機化合物として使用される方向へと推移しつつある。この光学的に純粋な有機化合物を合成する方法として、不斉外部配位子などを用いるエナンチオ選択的合成法は、その不斉源の触媒化が可能なことから、効率的な不斉合成法として期待されている方法である。したがって、エナンチオ選択的炭素-炭素結合形成反応は、光学活性有機化合物合成法として極めて重要な方法となり得る。一方、リチウムエノラートを用いる炭素-炭素結合形成反応は、現代の有機合成化学では頻繁に用いられる炭素-炭素結合形成反応であり、アルドール反応、マイケル反応など数多くの有用な反応様式がこれに含まれている。したがって、リチウムエノラートを用いる反応を、キラル外部配位子を用いて一般に立体選択的に行うことができれば、広範囲にわたり適用可能な不斉合成手段を提供できることになると考えられる。そこで筆者はリチウムエノラートの溶液構造とその反応性の関連に着目し、キラルな外部多座配位子によるリチウムエノラートのエナンチオ選択的反応の開発に着手した。従来、有機合成で用いられてきたリチウムエノラートはそれ自体反応性の高い化学種であるので、立体選択性発現のためにはその反応制御の工夫が必要となる。そこで、以下のようなエナンチオ選択的立体制御機構を想定した(Figure 1)。  Figure1.A general concept for e nantioselective reactions of lithium enolates. Figure1.A general concept for e nantioselective reactions of lithium enolates. すなわち、低配位性溶媒中でリチウムエノラートを生成させることにより、溶液中での会合度を上げてその反応性を低下させておく(1)。そこへキラルな多座配位子を加えることによりその会合度を下げ(2)、その結果不斉多座配位子の影響でキラルな環境下におかれたリチウムエノラートは反応性の高い真の活性種となり、はじめて求電子剤との立体選択的反応が進行するというものである。本論文は、このような考え方に基づくキラルな多座配位子を用いる各種リチウムエノラートのエナンチオ選択的アルキル化反応について、三章にわたって述べたものである。 第一章では、リチウムカルボン酸ジアニオンの不斉アルキル化反応について述べた。リチウムカルボン酸ジアニオンは、リチウムエノラートの中でも特に反応性の高いものであり、この高い反応性を制御できれば、他のリチウムエノラートも同様に制御可能であると考えた。また、リチウムカルボン酸ジアニオンには一般のリチウムエノラートに見られる幾何異性の問題がないと考えられるため、エノラートの 面選択的不斉アルキル化反応を行うには適した反応であると考えた。 面選択的不斉アルキル化反応を行うには適した反応であると考えた。 フェニル酢酸(3)を基質とするリチウムカルボン酸ジアニオンの臭化ベンジルによるベンジル化反応は、THFのような配位性溶媒においては定量的に進行した。一方、トルエンなどの非配位性溶媒では反応は全く進行せず、溶媒によってジアニオンの反応性を完全に抑えることができた。そこで、トルエンを溶媒として多座配位子による反応加速効果を検討したところ、五座配位子(5)で最もアルキル化反応が加速されることを明らかにした。しかし、高い不斉誘起能を有するキラルな四座、五座配位子を見出すことはできなかった(第一章、第三節)。不斉配位子の構造検討の中で、キラル二座配位子(6a)では中程度の不斉誘起が起きていたが(52%ee)、二座配位子であるために十分な反応加速効果が現れず、化学収率は24%と低いものであった。そこで、配位性溶媒であるTHFを溶媒として用いたところ、二座配位型キラルリチウムアミド(6b)を不斉配位子とすることで、より高い不斉誘起が起こることを見出した(第一章、第四節)(Scheme1)。  Scheme1 Scheme1 第二章では、環状化合物であるラクタム、ラクトンのエナンチオ選択的アルキル化反応について述べた。この場合は、基質が環状化合物であるためにそのリチウムエノラートの幾何異性は固定されている。 第一節では、ラクタムの不斉アルキル化について述べた。キラルな四座配位型リチウムアミド(9b)を用いてラクタム(7)のエノラートを生成させ、ベンジル化反応を行った。非配位性溶媒であるトルエンを溶媒として検討を行ったところ、低いながらも選択性が発現し(24%ee)、さらに臭化リチウムをこの系に添加することにより、大幅に選択性を向上させることができた(94%ee)。この結果から、高いエナンチオ選択性を誘起する活性種は、リチウムエノラート、臭化リチウム、キラルアミンから成る錯体であることが示唆された。また、9bの代わりにLDA-LiBrを用いた場合は反応が進行しないことから、四座配位子による顕著な反応加速効果を明らかにすることができた。更にこの反応における溶媒効果を検討した結果、溶媒のリチウムに対する配位性を下げるにつれてエナンチオ選択性が向上することを明らかにし、最終的にTMTHF(2,2,5,5-tetramethyltetrahydrofuran)を用いた場合に最も高い選択性(98%ee)を実現することができた(Scheme2)。また、臭化ベンジル以外のアルキル化剤としては、活性ハライドを用いることが高い選択性を発現させるには必要であった。7以外の基質については、六員環ラクタムの窒素上の置換基がメチル基からベンジル基に変わると選択性が低下し、五員環ラクタムを用いた場合は、収率、選択性ともに低下する結果となった。 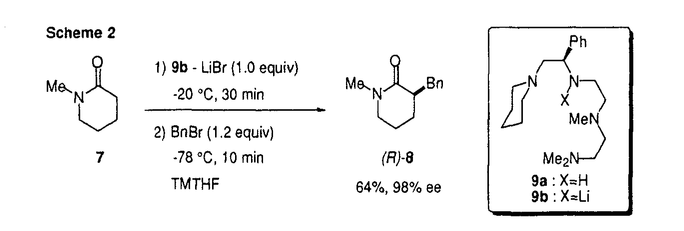 Scheme2 Scheme2 第二節では、ラクトンの不斉アルキル化について述べた。基質が , , -dimethyl- -dimethyl- -varelolactone(7)の場合は、ラクタムと同様高い選択性でアルキル化反応が進行した(Scheme3)。しかし、基質としてvarelolactoneを用いた場合は、そのリチウムエノラートの安定性が低いため副反応が起き、収率、選択性ともに低下した。また、ラクタムの場合と同様に五員環ラクトンでは収率、選択性ともに低い結果となった。したがって、五員環基質に対しては不斉配位子の構造を再検討する必要があることが分かった。 -varelolactone(7)の場合は、ラクタムと同様高い選択性でアルキル化反応が進行した(Scheme3)。しかし、基質としてvarelolactoneを用いた場合は、そのリチウムエノラートの安定性が低いため副反応が起き、収率、選択性ともに低下した。また、ラクタムの場合と同様に五員環ラクトンでは収率、選択性ともに低い結果となった。したがって、五員環基質に対しては不斉配位子の構造を再検討する必要があることが分かった。  Scheme3 Scheme3 第三節では、ラクタム、ラクトンの触媒的不斉アルキル化について述べた。最初にラクタムの触媒的不斉アルキル化反応を検討した。LDA-LiBrでラクタム(7)のリチウムエノラートを形成し、不斉触媒である9a(0.1eq)と触媒毒となる臭化リチウムを捕捉するTMPDA(N,N,N’,N’-tetramethylpropanediamine,2.0eq)を加えて触媒的不斉ベンジル化反応を行った(Scheme4)。その結果、低温における触媒回転は、極性溶媒を一部用いることにより促進することができ、’BuOMe-THF混合溶媒中で収率60%、47%eeで目的とするアルキル化体を得ることができた。しかし、ラクタムのリチウムエノラートの反応性が高いために、TMPDAによっても一部リチウムエノラートが活性化されて非選択的反応が進行してしまい、化学量論量の不斉源を用いた場合の高い選択性は、この場合実現できなかった。更に、ラクトン(10)に対する触媒的不斉アルキル化反応の検討を行ったところ、その触媒回転効率に問題が残るが、81%eeという高い不斉収率をもって目的とするアルキル化体を得ることができた(Scheme5)。したがって、ラクトンのリチウムエノラート程度の反応性ならば、十分にこの考え方によって触媒的不斉アルキル化反応を行えることが分かった。 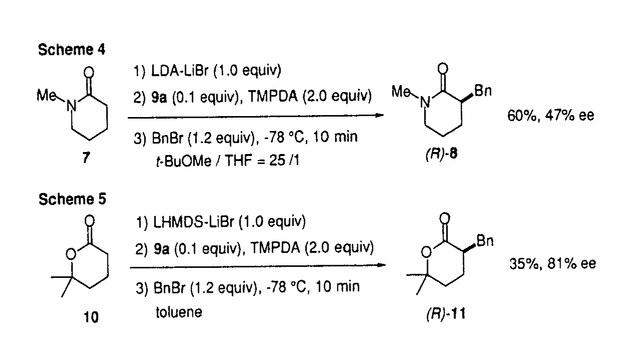 図表Scheme4 Scheme5 図表Scheme4 Scheme5 第三章では、単純な鎖状化合物のエナンチオ選択的アルキル化反応について述べた。単純な鎖状構造の基質では、リチウムエノラートの二つの幾何異性体が生成することが予想される。そこで、最初にE(trans)-エノラートを優先して生成すると報告されている鎖状エステルを基質として検討を行った(第三章、第二節)。これは、第二章におけるラクタムやラクトンのアルキル化反応で、9b-LiBrを用いることにより高い不斉誘起を起こすことができたためである。しかし、9b-LiBrでt-Buthyl propionateのリチウムエノラートを生成させると、その幾何異性の生成比はE(trans):Z(cis)=3:1であることが分かり、十分なエナンチオ選択性を実現するのはこの場合困難であると判断した。そこで、配位子の構造または反応条件等の変化に影響を受けずに、ほぼ単一のZ-エノラートが生成する傾向のある鎖状アミド(12)を基質として検討を行った(第三章、第三節)。まず、キラル外部配位子として六員環ラクトン、ラクタムに対して有効であった9b-LiBrを用いて不斉アルキル化反応を検討したが、満足できる結果は得られなかった(18%ee)。そこで、類似の構造を有する不斉五座配位子について検討したところ選択性が40%eeにまで向上したが、これ以上の選択性を実現することはできなかった。そこで、固相合成法を用いて迅速に不斉五座配位子合成を行い、新たな骨格の不斉配位子探索を行った。その結果、プロリン由来の五員環構造が五座配位子の構造の中で適切な位置に配置されると、12に対するアルキル化反応において選択性が見られるようになった。更に、その不斉五座配位子の構造から各種アミノ酸由来の置換基の効果を検討した結果、中程度のエナンチオ選択性(47%ee)を実現する配位子14を見出した。この構造を基に、液相合成法にて新たに不斉五座配位子(15)を合成したところ、62%eeというこの検討の中で最も高い不斉誘起を起こす配位子を見出すことができた(Scheme6)。この結果より、固相合成を用いる不斉配位子探索の有効性を示すことができたと考えている。  Scheme6 Scheme6 以上、リチウムエノラートのエナンチオ選択的反応は、非配位性溶媒でリチウムエノラートの反応性を抑え、そしてキラルな多座配位子によって反応を加速して立体選択性を発現させるという機構で行えることを明らかにした。高い選択性を発現するには、適切な構造を有するキラルな多座配位子が必要となる。これまでE-エノラートに対しては極めて優れた不斉四座配位子(9a)が見出されていたが、この研究により、Z-エノラートに対する有効な不斉五座配位子(15)を見出すことができた。今後の研究において、それぞれの不斉配位子がリチウムエノラートに対してどのような不斉空間を形成しているのかを明らかにできれば、より優れたキラルな多座配位子を見出すことができるものと期待される。 |