| 内容要旨 | | 【序論】 遺伝子DNAは、様々な内的あるいは外的な要因により常に損傷を受けている。これらを放置すればDNA複製や転写が阻害され、時として突然変異が誘起されて細胞のがん化や老化の原因となる。こうした事態を避けるため、生物は進化の過程で種々のDNA修復機構を獲得してきた。ヌクレオチド除去修復機構(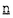 ucleotide ucleotide  xcision xcision  epair;NER)はその中でも広範なDNA損傷、例えば紫外線によるピリミジンダイマー、シスプラチンの鎖内架橋による損傷や化学物質の結合など、比較的’大きな’損傷に対応する。NERには、転写の鋳型となるDNA鎖から損傷を除去する’速い’反応( epair;NER)はその中でも広範なDNA損傷、例えば紫外線によるピリミジンダイマー、シスプラチンの鎖内架橋による損傷や化学物質の結合など、比較的’大きな’損傷に対応する。NERには、転写の鋳型となるDNA鎖から損傷を除去する’速い’反応( ranscription- ranscription- oupled oupled  epair;TCR)と、それ以外のゲノム全体の損傷に対応する’遅い’反応( epair;TCR)と、それ以外のゲノム全体の損傷に対応する’遅い’反応( lobal lobal  enome enome  epair;GGR)の2つの経路が存在する。ヒトにおいてNER機構に欠損を持つ常染色体性劣性遺伝病として色素性乾皮症( epair;GGR)の2つの経路が存在する。ヒトにおいてNER機構に欠損を持つ常染色体性劣性遺伝病として色素性乾皮症(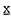 eroderma eroderma  igmentosum;XP)があり、AからGまでの7相補性群に分かれる。GGRのみに欠損を持つC群を相補する因子(XPC)は、出芽酵母のRAD23と相同性をもつ58kDaの蛋白質(HR23B)との複合体として精製された(1)。XPCは出芽酵母のRAD4と一部相同性を持つものの、そのアミノ酸配列上からは機能を示唆する配列は見つからず、その生化学的性質として一本鎖(ss)DNAに強く結合することのみが分かっていた。その後の解析により、HR23BはXPCの相補活性を増強すること(2)、XPC/HR23B複合体には損傷DNAに優先的に結合する活性があること(3)、転写因子TFIIHと相互作用すること(4)が見いだされたが、それらの機能と構造の相関についての解析は報告されていない。そこでバキュロウイルス発現系を用いてXPC欠失変異体を作成し、HR23B、ssDNA、損傷DNA、TFIIHの構成因子であるp62およびXPBとの結合について検討した。さらにGGRの経路におけるXPC/HR23B複合体による最初のDNA損傷認識に続くステップとして、TFIIHをXPC/HR23B複合体が導入するということが強く示唆される結果を得た。 igmentosum;XP)があり、AからGまでの7相補性群に分かれる。GGRのみに欠損を持つC群を相補する因子(XPC)は、出芽酵母のRAD23と相同性をもつ58kDaの蛋白質(HR23B)との複合体として精製された(1)。XPCは出芽酵母のRAD4と一部相同性を持つものの、そのアミノ酸配列上からは機能を示唆する配列は見つからず、その生化学的性質として一本鎖(ss)DNAに強く結合することのみが分かっていた。その後の解析により、HR23BはXPCの相補活性を増強すること(2)、XPC/HR23B複合体には損傷DNAに優先的に結合する活性があること(3)、転写因子TFIIHと相互作用すること(4)が見いだされたが、それらの機能と構造の相関についての解析は報告されていない。そこでバキュロウイルス発現系を用いてXPC欠失変異体を作成し、HR23B、ssDNA、損傷DNA、TFIIHの構成因子であるp62およびXPBとの結合について検討した。さらにGGRの経路におけるXPC/HR23B複合体による最初のDNA損傷認識に続くステップとして、TFIIHをXPC/HR23B複合体が導入するということが強く示唆される結果を得た。 【結果と考察】I XPC欠失変異体とHR23Bの共発現およびHR23Bに対するXPCの結合領域 バキュロウイルスにより発現させたrecombinant XPC(rXPC)は、XP-C細胞抽出液を用いた無細胞NER系において修復欠損を相補することを既に報告している(2)。そこで図1に示すようなXPC欠失変異体(XPC )をC末端にヒスチジンタグをつけたHR23Bと共発現し、様々な結合実験に供した。 )をC末端にヒスチジンタグをつけたHR23Bと共発現し、様々な結合実験に供した。  図1 XPC欠失変異体 図1 XPC欠失変異体 HR23Bに対する結合領域については、各XPC /HR23B-His抽出液からNi-NTAアガロースビーズによる沈降物を回収し、抗XPCポリクローナル抗体を用いたウェスタンブロッティングによりHR23B-Hisと共沈降したXPC欠失変異体を検出した。この結果、S496からG734までの239アミノ酸がXPCにおけるHR23B結合領域の中心であり、さらにM118からP495までの378アミノ酸の領域、およびY735からE815までの81アミノ酸の領域はより安定した複合体の形成に寄与すると考えられた(図4)。 /HR23B-His抽出液からNi-NTAアガロースビーズによる沈降物を回収し、抗XPCポリクローナル抗体を用いたウェスタンブロッティングによりHR23B-Hisと共沈降したXPC欠失変異体を検出した。この結果、S496からG734までの239アミノ酸がXPCにおけるHR23B結合領域の中心であり、さらにM118からP495までの378アミノ酸の領域、およびY735からE815までの81アミノ酸の領域はより安定した複合体の形成に寄与すると考えられた(図4)。 以上の結果のもとに、HR23B-Hisと複合体を形成できるwild-type XPC、N 117、C 117、C 735、C 735、C 816の4種のXPC 816の4種のXPC は、HR23B-HisのNi-NTAアガロースに対する結合活性、およびXPC は、HR23B-HisのNi-NTAアガロースに対する結合活性、およびXPC のホスホセルロースに対する結合活性を利用した2本のカラムククロマトグラフィにより、それぞれ複合体として精製された。ここで精製したXPC のホスホセルロースに対する結合活性を利用した2本のカラムククロマトグラフィにより、それぞれ複合体として精製された。ここで精製したXPC /HR23B-His複合体は、wild-typeXPC/HR23B-His複合体と同様XPC /HR23B-His複合体は、wild-typeXPC/HR23B-His複合体と同様XPC とHR23B-Hisが1:1の複合体であり、HR23B結合についてはwild-typeと同様の結合様式であると考えられた。これらの精製XPC とHR23B-Hisが1:1の複合体であり、HR23B結合についてはwild-typeと同様の結合様式であると考えられた。これらの精製XPC /HR23B複合体もまた以下の実験に供した。 /HR23B複合体もまた以下の実験に供した。 IIssDNAおよび損傷DNAに対する結合領域 各XPC変異体/HR23B-His抽出液から0.3M NaClの条件下でssDNAアガロースによる沈降物を回収し、ウェスタンブロッティングによりssDNAに結合して沈降した変異体XPCを同定した(図4)。N末端側606アミノ酸を欠失したN 606でもwild-type XPCと同様にssDNAに強く結合した。C末端欠失変異についてはC 606でもwild-type XPCと同様にssDNAに強く結合した。C末端欠失変異についてはC 816ではssDNA結合活性が見られたが、C 816ではssDNA結合活性が見られたが、C 735で活性が失われた。これよりL607からE815までの209アミノ酸がssDNA結合領域と考えられる。 735で活性が失われた。これよりL607からE815までの209アミノ酸がssDNA結合領域と考えられる。 次に精製した4つの複合体(XPC、N 117、C 117、C 735、またはC 735、またはC 816/HR23B-His)と、同じく精製したHis-N 816/HR23B-His)と、同じく精製したHis-N 606とHis-607-734(L607からG734までの128アミノ酸のポリペプチド)を用いてN-AAAF損傷DNAへの結合実験を行った。4つの複合体についてはすべて損傷DNAに対する優先的な結合が認められた。またssDNAに結合したHis-N 606とHis-607-734(L607からG734までの128アミノ酸のポリペプチド)を用いてN-AAAF損傷DNAへの結合実験を行った。4つの複合体についてはすべて損傷DNAに対する優先的な結合が認められた。またssDNAに結合したHis-N 606だけでなくHis-607-734にも弱いながら優先的に損傷DNAに結合する活性が見いだされた。よってL607からG734までの128アミノ酸が損傷DNA結合領域の中心であり、さらにY735からC末端までの206アミノ酸の領域は損傷DNA結合を促進すると結論した(図4)。 606だけでなくHis-607-734にも弱いながら優先的に損傷DNAに結合する活性が見いだされた。よってL607からG734までの128アミノ酸が損傷DNA結合領域の中心であり、さらにY735からC末端までの206アミノ酸の領域は損傷DNA結合を促進すると結論した(図4)。 IIITFIIH構成因子であるp62およびXPBに対するXPCの結合 p62およびXPBは、N末端側にグルタチオン-S-トランスフェラーゼ(GST)を持ったGST融合蛋白質として大腸菌内で発現、精製した。各XPC変異体/HR23B-His抽出液と精製したGST-p62またはGST-XPBをバッファー中で結合させた後、グルタチオンセファロースビーズにより沈降物を回収、ウェスタンブロッティングによりGST-p62もしくはGST-XPBと共沈降したXPC変異体を検出した。p62との結合に関しては、N末端側で117アミノ酸を欠失したN 117には活性が見られたが、それ以上の欠失では結合できなかった。C末端側では125アミノ酸欠失したC 117には活性が見られたが、それ以上の欠失では結合できなかった。C末端側では125アミノ酸欠失したC 816でもp62と結合できなかった。XPBとの結合活性は、N末端、C末端どちらを欠失しても失われた(図2)。以上からp62およびXPBに対するXPCの結合領域の同定には至らなかった。しかしIで精製した4種の複合体それぞれで、p62またはXPBに対する結合活性が異なることがわかった。 816でもp62と結合できなかった。XPBとの結合活性は、N末端、C末端どちらを欠失しても失われた(図2)。以上からp62およびXPBに対するXPCの結合領域の同定には至らなかった。しかしIで精製した4種の複合体それぞれで、p62またはXPBに対する結合活性が異なることがわかった。  図2 p62およびXPBとの結合I:5%input 6:p62 elute B:XPB eluteIVNER活性とp62およびXPBとの相互作用の相関 図2 p62およびXPBとの結合I:5%input 6:p62 elute B:XPB eluteIVNER活性とp62およびXPBとの相互作用の相関 4種の精製複合体(XPC/HR23B-His、N 117/HR23B-His、C 117/HR23B-His、C 735/HR23B-His、C 735/HR23B-His、C 816/HR23B-His)を用いてin vitro NERアッセイを行った。N 816/HR23B-His)を用いてin vitro NERアッセイを行った。N 117はwild-type XPC複合体に対しておよそ50%程度の相補活性しか示さなかった。さらにC 117はwild-type XPC複合体に対しておよそ50%程度の相補活性しか示さなかった。さらにC 735およびC 735およびC 816については活性が全く検出できなかった。またアッセイに加える蛋白量を増やしても活性の上昇は見られなかった(図3)。XPC、N 816については活性が全く検出できなかった。またアッセイに加える蛋白量を増やしても活性の上昇は見られなかった(図3)。XPC、N 117、C 117、C 735、C 735、C 816のそれぞれについて、HR23B、DNA、TFIIHに対する相互作用について表1にまとめた。N 816のそれぞれについて、HR23B、DNA、TFIIHに対する相互作用について表1にまとめた。N 117はwild-type XPCと比べてTFIIHのサブユニットの一つであるXPBとの相互作用のみが失われている。このことから、N 117はwild-type XPCと比べてTFIIHのサブユニットの一つであるXPBとの相互作用のみが失われている。このことから、N 117ではTFIIHとの相互作用がwild-type XPCに比べて弱いことが予想された。またC 117ではTFIIHとの相互作用がwild-type XPCに比べて弱いことが予想された。またC 816は、XPCが相互作用するTFIIHの2つのサブユニットp62とXPBともに相互作用できないため、TFIIHと相互作用できないと予想された。つまりこれらの2つのXPC 816は、XPCが相互作用するTFIIHの2つのサブユニットp62とXPBともに相互作用できないため、TFIIHと相互作用できないと予想された。つまりこれらの2つのXPC は、XPCの相互作用のうちTFIIHに対する活性のみがwild-type XPCと異なる変異体であると考えられる。XPCは前述したとおりNER機構において最初に損傷DNAに結合する。N は、XPCの相互作用のうちTFIIHに対する活性のみがwild-type XPCと異なる変異体であると考えられる。XPCは前述したとおりNER機構において最初に損傷DNAに結合する。N 117が50%程度NER活性を失い、C 117が50%程度NER活性を失い、C 816ではNER活性を全く示さないことと考え合わせると、XPCがDNA損傷を認識した後TFIIHがXPCとの相互作用により次に導入されなければ、それに続くと考えられる他のNER因子、XPAやRPAなどの導入が起こらないことでNER反応の損傷認識のステップが成立せず、その結果、NER反応が進行しないことが示唆された。 816ではNER活性を全く示さないことと考え合わせると、XPCがDNA損傷を認識した後TFIIHがXPCとの相互作用により次に導入されなければ、それに続くと考えられる他のNER因子、XPAやRPAなどの導入が起こらないことでNER反応の損傷認識のステップが成立せず、その結果、NER反応が進行しないことが示唆された。  図3 XPC欠失変異体のin vitro NER活性 図3 XPC欠失変異体のin vitro NER活性 表1.XPC変異体の、HR23B、DNA、TFIIHに対する相互作用のまとめ. 表1.XPC変異体の、HR23B、DNA、TFIIHに対する相互作用のまとめ. 以上の実験により、XPCにおけるDNA結合活性およびHR23B結合活性に必要な領域を決定した。これらの領域は出芽酵母のRAD4との相同性が指摘されている部分(5、図4)と重複しているものの、一部N末端側にずれていた(図4)。しかし、この部分のアミノ酸配列について改めて検討したところ、RAD4とXPCの間で十分に高い相同性が確認された。このことは、この領域の機能が進化の過程で保存されている重要なものであることを示している。さらにTFIIH構成成分であるp62およびXPBに結合しない欠失変異体を用いた実験により、XPCの機能において、損傷DNAへの結合だけでなく、TFIIHとの相互作用がNER機構の進行に非常に重要であることが明らかになった。現在、GGRの経路においてXPC/HR23Bによる最初の損傷認識に続くステップは明らかになっていないが、TFIIH以外のNER因子とXPCの相互作用は報告されておらず、損傷に結合したXPCが蛋白質間相互作用によってTFIIHを引き込むことがNER反応機構において特に重要であることが強く示唆された。HR23BとXPCの相互作用がNER活性を促進することと合わせて、NER因子それぞれの秩序だった相互作用がNER反応全体の正しい進行に必要であると考えられる。  図4 HR23BおよびDNA結合領域【参考文献】1.Masutani,C.,K.Sugasawa,J.Yanagisawa,T.Sonoyama,M.Ui,T.Enomoto,K.Takio,K.Tanaka,P.J.van der Spek,D.Bootsma,J.H.J.Hoeijmakers,and F.Hanaoka.1994.EMBO J.13:1831-1843.2.Sugasawa,K.,C.Masutani,A.Uchida,T.Maekawa,P.J.van der Spek,D.Bootsma,J.H.J.Hoeijmakers,and F.Hanaoka.1996.Mol.Cell.Biol.16:4852-4861.3.Sugasawa,K.,J.M.Y.Ng,C.Masutani,S.Iwai,P.J.van der Spek,A.P.M.Eker,F.Hanaoka,D.Bootsma,and J.H.J.Hoeijmakers.1998.Mol.Cell 2:223-232.4.Yokoi,M.,et al.In preparation.5.Legerski,R.,and C.Peterson.1992.Nature 359:70-73. 図4 HR23BおよびDNA結合領域【参考文献】1.Masutani,C.,K.Sugasawa,J.Yanagisawa,T.Sonoyama,M.Ui,T.Enomoto,K.Takio,K.Tanaka,P.J.van der Spek,D.Bootsma,J.H.J.Hoeijmakers,and F.Hanaoka.1994.EMBO J.13:1831-1843.2.Sugasawa,K.,C.Masutani,A.Uchida,T.Maekawa,P.J.van der Spek,D.Bootsma,J.H.J.Hoeijmakers,and F.Hanaoka.1996.Mol.Cell.Biol.16:4852-4861.3.Sugasawa,K.,J.M.Y.Ng,C.Masutani,S.Iwai,P.J.van der Spek,A.P.M.Eker,F.Hanaoka,D.Bootsma,and J.H.J.Hoeijmakers.1998.Mol.Cell 2:223-232.4.Yokoi,M.,et al.In preparation.5.Legerski,R.,and C.Peterson.1992.Nature 359:70-73. |