CD38はリンパ球の分化マーカーとして同定された1回膜貫通型、II型の糖タンパク質であり、モノクローナル抗体を用いた解析からリンパ球のアポトーシスや細胞接着への関与が指摘されている。一方、細胞内Ca2+の動員作用をもつことが期待されるcyclic ADP-riboseは、CD38の細胞外領域に存在するADP-ribosyl cyclaseによって生成することが報告され、CD38は分化マーカー以外に酵素活性をもつ分子としても脚光を浴びた。しかしながら、CD38にはcyclic ADP-ribose合成活性と同時にその100倍以上も強いNADase(NAD+のN-グリコシド結合を切断してnicotinamideとADP-riboseに分解する)活性が存在するが、その酵素活性の生理的役割については不明な点が多い。 本研究では、リンパ球以外の細胞、特にラット脳でのCD38の分布を調べ、その脳細胞におけるNADaseの活性調節機構を解析した。また、この活性調節機構によって制御されるNADaseのproductの役割について解析した。さらに、これらの活性に関する機能に加え、内在性の相互作用分子の検索を行ったので報告する。 1.ラット脳組織に存在するNADase活性:CD38としての同定 脳組織にNADase活性が存在することは古くから知られていたが、リンパ球分化マーカーとして同定されたCD38/NADaseとの関連は不明瞭であった。そこで、ラットCD38に対する抗体を作成し、脳でのCD38の分布とNADase活性との関連を調べた。胎性ラット脳初代培養におけるCD38の発現量は主にアストロサイトにおいて高く、それに対応して高いNADase活性も認められた。また、ゲル内でNADase活性を測定する新規の方法(in gel NADase assay法)を用いて解析したところ、アストロサイトのNADaseは分子量約46kDaのCD38であることを同定できた(Fig.1)。  Fig.1 アストロサイトのNADaseがCD38であることの確認(in gelNADase assay法を用いて) Fig.1 アストロサイトのNADaseがCD38であることの確認(in gelNADase assay法を用いて)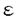 NAD+はNADaseにより分解されると NAD+はNADaseにより分解されると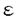 ADP-riboseとなり、蛍光強度を増すために、NADaseをバンドとして検出できる。この方法を用いてアストロサイトのNADaseを解析したところ、抗CD38抗体immunoblotのバンドと一致し.CD38のNADase活性を抑えるZn2+存在下でバンドが消失したことから、脳のNADaseがCD38であることが確認できた。 ADP-riboseとなり、蛍光強度を増すために、NADaseをバンドとして検出できる。この方法を用いてアストロサイトのNADaseを解析したところ、抗CD38抗体immunoblotのバンドと一致し.CD38のNADase活性を抑えるZn2+存在下でバンドが消失したことから、脳のNADaseがCD38であることが確認できた。 さらに、蛍光誘導体を用いたin gel NADase assay法を応用して、インタクト細胞の表層上のNADaseを可視化することに成功した(Fig.2)。今回用いた方法は未知のNADaseを解析する上で有用なtoolとなると考えられる。  Fig.2インタクト細胞表層上のNADase活性の可視化NAD+の蛍光誘導体( Fig.2インタクト細胞表層上のNADase活性の可視化NAD+の蛍光誘導体(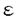 NAD+)を用い、共焦点レーザー顕微鏡で観察した。アストロサイトの細胞表層上には強いNADase活性が見られたが、CD38を発現していないニューロンではほとんど見られなかった。矢印はニューロンの存在箇所を示す。2.CD38/NADase活性の特性と不活性化 NAD+)を用い、共焦点レーザー顕微鏡で観察した。アストロサイトの細胞表層上には強いNADase活性が見られたが、CD38を発現していないニューロンではほとんど見られなかった。矢印はニューロンの存在箇所を示す。2.CD38/NADase活性の特性と不活性化 アストロサイトのNADaseはCD38が担っていることが明らかとなった。そこで、アストロサイトのCD38/NADaseの特性を検討するうえで、基質であるNAD+を添加してみた。すると、NAD+処理時間と共に細胞表層上のimmunoreactiveなCD38が消失していくことがわった(Fig.3)。これと同時に、NADase活性の低下(不活性化)が見られた(Fig.4)。この現象は、CD38の反応生成物では見られず、またnicotinamideを類似化合物に置き換えたNAD+誘導体(基質とならない誘導体)でも見られなかった(Fig.5)。したがって、CD38は基質分解過程で(product inhibitionとは異なる機構で)特異的に不活性化することが明らかとなった。このとき、detergentで可溶化時のCD38の局在の変化、NADase活性の回復は見られず、また、internalizationにたいする抑制剤の効果が見られなかったことからinternalizationでは説明できないと考えられた。さらに、immunoreactiveなCD38の量は変化していないこと、CD38の分子量は変化していないことから、CD38のdegradationでもないと考えられた。  Fig.3NAD+の添加により細胞表層のimmunoreactiveなCD38は消失する。ラットアストロサイトにNAD+を添加して0〜18時間培養後、1次抗体に抗ラットCD38pAb、2次抗体にFITC-抗ウサギIgGmAbを用いて染色し共焦点レーザー顕微鏡により観察した。NAD+を添加後、経時的に細胞表層のimmunoreactiveなCD38が消失していく様子が認められる。 Fig.3NAD+の添加により細胞表層のimmunoreactiveなCD38は消失する。ラットアストロサイトにNAD+を添加して0〜18時間培養後、1次抗体に抗ラットCD38pAb、2次抗体にFITC-抗ウサギIgGmAbを用いて染色し共焦点レーザー顕微鏡により観察した。NAD+を添加後、経時的に細胞表層のimmunoreactiveなCD38が消失していく様子が認められる。 Fig.4アストロサイトにおけるNADaseの不活性化NAD+の処理時間、処理濃度依存的に細胞表層上のNADaseが不活性化を起こしたが、この現象はCD38の反応生成物では起きない(product inhibitionとは異なるメカニズムの可能性)。 Fig.4アストロサイトにおけるNADaseの不活性化NAD+の処理時間、処理濃度依存的に細胞表層上のNADaseが不活性化を起こしたが、この現象はCD38の反応生成物では起きない(product inhibitionとは異なるメカニズムの可能性)。 Fig.5基質依存的な細胞表層のNADaseの不活性化〜NAD+類似化合物を用いて〜100 Fig.5基質依存的な細胞表層のNADaseの不活性化〜NAD+類似化合物を用いて〜100 MのNAD+類似化合物をアストロサイトに添加し、18時間培養してから細胞表層のNADaseを測定した。CD38の基質となる化合物のみNADaseの不活性化を引き起こしている。 MのNAD+類似化合物をアストロサイトに添加し、18時間培養してから細胞表層のNADaseを測定した。CD38の基質となる化合物のみNADaseの不活性化を引き起こしている。 そこで、CD38の精製標品を用いてNADaseの不活性化を調べた。精製したCD38をNAD+で処理し、in gel NADase assay法により解析したところ、細胞の時と同様にNADaseの不活性化が見られた(Fig.6左)。つまり不活性化にはコファクターを必要としなかった。不活性化についてさらに情報を得るために等電点電気泳動による分離を試みたところ、不活性化したCD38は、劇的に塩基性側に移行していた(Fig.6右)。これはCD38のチャージが変化したことを示しており、CD38が化学的修飾をうけている可能性を示唆する。このような修飾は現在のところ知られていないため、注目に値する。  Fig.6CD38精製標品を用いたNADaseの不活性化と性状変化CD38精製標品をNAD+により不活性化させ、in gel NADase assay(左)あるいは等電点電気泳動(右)により解析した。不活性化したCD38では等電点がbasic側にシフトしているspotが検出された.3.CD38/NADaseで生成したADP-riboseによるタンパク質のadvanced glycation end products(AGE)化 Fig.6CD38精製標品を用いたNADaseの不活性化と性状変化CD38精製標品をNAD+により不活性化させ、in gel NADase assay(左)あるいは等電点電気泳動(右)により解析した。不活性化したCD38では等電点がbasic側にシフトしているspotが検出された.3.CD38/NADaseで生成したADP-riboseによるタンパク質のadvanced glycation end products(AGE)化 ここまでのことから、CD38はアストロサイトの表層にも存在し、化学的修飾によるNADase活性調節機構を備えていることが明らかとなった。しかし、CD38のNADaseのproductの役割は未だ明らかになっていない。そこで、productのうちADP-riboseの役割について解析した。 ADP-riboseが細胞内で、還元糖となりhistonのアミノ基に修飾を付加する反応が知られており、advanced glycation end products略してAGE化proteinを形成する(Fig.7)。一方、細胞外では主にglucoseがAGE化の基質となることが知られている。AGE-proteinはAGEレセプターに結合するほか細胞外matrixに結合し、老化や血管系の病気に関与することが示唆されている。ここで、ADP-riboseとglucoseとではどちらがAGE化の基質となり易いのかを調べたところ(Fig.8)、ADP-riboseはglucoseよりも良いAGE化の基質となることがわかった。このことから、細胞外に酵素活性を向けたCD38は、glucoseよりも、AGE化能の高いADP-riboseを生成することで、細胞外のAGE化を促進している可能性を考えた。  Fig.7細胞内外におけるAGE化とCD38の細胞外のAGE化供与体としての可能性細胞内ではヒストンがADP-riboseによりnon-enzymaticに修飾をうけAGE化される。一方、細胞外ではglucoseがAGE化の基質となり、様々なタンパクがAGE化をうける。 Fig.7細胞内外におけるAGE化とCD38の細胞外のAGE化供与体としての可能性細胞内ではヒストンがADP-riboseによりnon-enzymaticに修飾をうけAGE化される。一方、細胞外ではglucoseがAGE化の基質となり、様々なタンパクがAGE化をうける。 Fig.8glucoseとADP-riboseで、どちらがAGE化の基質になり易いかの検討glucoseあるいはADP-riboseをBSAとともにincubationし、AGE化されたBSAを抗AGE-BSA抗体で検出した Fig.8glucoseとADP-riboseで、どちらがAGE化の基質になり易いかの検討glucoseあるいはADP-riboseをBSAとともにincubationし、AGE化されたBSAを抗AGE-BSA抗体で検出した そこで、BSAをモデル基質として用い、NAD+ならびにCD38の精製標品とともにincubationし、AGE化を抗AGE-BSA抗体で評価した。すると、NAD+のみではBSAのAGE化はおこらないが、CD38が加わるとAGE化の促進が見られた。 さらにこのAGE化促進の現象が実際の細胞表層に存在するCD38によっても起こるかどうかを確認した(Fig.9)。NADase強さ、つまりはCD38の発現量に応じて細胞外のAGE化の促進が認められた。  Fig.9細胞表層のCD38/NADaseによるAGE化の促進THP-1/CD38 stable cloneをBSA、50 Fig.9細胞表層のCD38/NADaseによるAGE化の促進THP-1/CD38 stable cloneをBSA、50 Mのヌクレオチド存在下で培養し、culture medium中のBSAのAGE化の度合いを抗AGE-BSA抗体により検出した。CD38の発現量つまりはNADase活性の強さに応じ、NAD+存在下でAGE化が促進される Mのヌクレオチド存在下で培養し、culture medium中のBSAのAGE化の度合いを抗AGE-BSA抗体により検出した。CD38の発現量つまりはNADase活性の強さに応じ、NAD+存在下でAGE化が促進される このことより、CD38は酵素活性を細胞外に向け、glucoseよりも高いAGE化能を持つADP-riboseを作り出し、細胞外の蛋白質のAGE化を促進していると考えられた。 4.CD38と相互作用する分子の検索 CD38の酵素として役割以外に、CD38のリガンドないしはレセプターとしての役割に注目した。今までに、抗CD38抗体を用いたCD38の解析が行われてきたが、生理的な相互作用分子についてはあまり明らかになっていない。そこで、CD38と相互作用する分子の検索をFar western blot法を用いて行った。 CD38のN末端にFLAG tagを付加したCD38を作成し、manmalianの細胞に発現させこれをprobeとした。また、tunicamysin処理により糖鎖修飾のないFLAG-CD38も準備した(Fig10A)。これらをmembraneに吸着させた蛋白質とともにhybridizeさせ、probeを固定した後、抗FLAG抗体によってprobeを検出した。すると、コントロールには見られないないいくつかのバンドが検出され、その中でも、約50kDaのバンドがspleenの膜画分で強く検出された(Fig.10B)。この50kDaのバンドは、脳や、血球系細胞株であるHL60細胞では弱かったことから、組織特異性のある分子と考えられた。さらに、このバンドは糖鎖修飾のないCD38では検出できなかったことから、糖鎖が結合に重要であることもわかった。今後、この分子の同定が、CD38の更なる機能の解明の糸口になると考えられる。  Fig.10CD38と相互作用する分子の検素〜Far western blot法を用いて〜Far western blot法の模式図(A)。ラットspleen膜画分に約50kDaのバンドが強く検出された(B)。また、このバンドは糖鎖修飾の無いCD38では検出されなかった。5.CD38に結合した糖鎖の役割:レクチンによるNADase活性の抑制 Fig.10CD38と相互作用する分子の検素〜Far western blot法を用いて〜Far western blot法の模式図(A)。ラットspleen膜画分に約50kDaのバンドが強く検出された(B)。また、このバンドは糖鎖修飾の無いCD38では検出されなかった。5.CD38に結合した糖鎖の役割:レクチンによるNADase活性の抑制 新たに見いだされた、50kDaの相互作用分子は結合にCD38の糖鎖を必要とすることが示唆された。CD38にはアミノ酸配列から予測される、4つのN-結合型糖鎖が存在するが、この糖鎖のCD38へ寄与は重要と考えられる。 そこで、CD38のNADaseに対するレクチンの影響を調べた。糖の種類に特異性のあるいくつかの代表的なレクチンを、CD38とともにincubationし、NADase活性を測定したところ、レクチンは濃度依存的にNADaseを抑制した(Fig11)。さらに、tunicamysin処理により、糖鎖修飾を無くしたCD38に対しては、レクチンの作用が消失したことより、レクチンが確かに糖鎖に結合して抑制をかけていることが明らかとなった。これらのことより、CD38にたいするレクチン様細胞外成分の存在とその関与が期待される。  Fig.11レクチンによるCD38/NADase活性抑制〜糖鎖修飾の影響〜レチノイン酸によってCD38の発現誘導をかけたHL-60細胞膜画分を各レクチンとともにincubationし、NADase活性に対するレクチンの影響を調べた。レクチンはCD38のNADaseを抑制したが(右図)、tunicamysin処理により、糖鎖修飾をなくしたCD38(inseL 36kDa)においては、レクチンによるNADase活性抑制効果は消失した(左図)。RCA120;ricin120,AAL;alcuria aurantia,WGA;wheal germ agglutinin,ConA;Concanavalin Aまとめ Fig.11レクチンによるCD38/NADase活性抑制〜糖鎖修飾の影響〜レチノイン酸によってCD38の発現誘導をかけたHL-60細胞膜画分を各レクチンとともにincubationし、NADase活性に対するレクチンの影響を調べた。レクチンはCD38のNADaseを抑制したが(右図)、tunicamysin処理により、糖鎖修飾をなくしたCD38(inseL 36kDa)においては、レクチンによるNADase活性抑制効果は消失した(左図)。RCA120;ricin120,AAL;alcuria aurantia,WGA;wheal germ agglutinin,ConA;Concanavalin Aまとめ CD38はリンパ球ばかりではなく、脳のアストロサイトにも存在する分子であることから、その働きは多岐にわたる可能性を秘めている。その中の機能の一つとして、CD38の持つNADaseは、AGE化を促進する働きを持つ可能性が示唆された。そして、CD38/NADaseは化学的な修飾による非可逆的、あるいはレクチン様物質による可逆的活性調節機構によって調節されるというユニークな特性を持っていることが明らかとなった。また、これらの酵素活性に関する機能に加え、CD38と相互作用する分子が存在することから、この分子の新たなシグナル伝達因子あるいは細胞接着因子として役割が期待される。  まとめ まとめ |