| 【背景】 モノクローナル抗体(mAb)FH6は、糖脂質NeuAc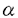 2-3Gal 2-3Gal 1-4(Fuc 1-4(Fuc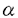 1-3)GlcNAc 1-3)GlcNAc 1-3Gal 1-3Gal 1-4(Fuc 1-4(Fuc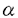 1-3)GlcNAc 1-3)GlcNAc 1-3Gal 1-3Gal 1-4Glc 1-4Glc 1-1Cerを免疫することで得られた抗体で、この糖脂質の糖鎖部分に特異的に反応する抗シアリルルイスX抗体であると考えられている。当研究室により、大腸がん患者病理組織の免疫組織化学的染色において、mAb FH6の染色性の高かった患者は術後生存率が低いこと、また肝臓転移を伴った大腸がん患者の病理切片において原発巣に比べ、転移巣で有意にmAb FH6の染色性が高いことが報告されてきた。しかしながらmAb FH6が認識すると考えられている糖鎖の末端部分の構造を認識する別の抗シアリルルイスX抗体mAb KM93を用いた大腸がん組織の免疫化学的染色においては、上述のような患者の予後との相関は見られない。また、19種類のヒト大腸がん細胞株を用いたmAb FH6およびmAb KM93によるフローサイトメトリー分析において、mAb FH6では染色されるがmAb KM93では染色されない細胞株が見出された。従って抗シアリルルイスX抗体と呼ばれる抗体が認識する糖鎖は、多様性が存在することが考えられる 1-1Cerを免疫することで得られた抗体で、この糖脂質の糖鎖部分に特異的に反応する抗シアリルルイスX抗体であると考えられている。当研究室により、大腸がん患者病理組織の免疫組織化学的染色において、mAb FH6の染色性の高かった患者は術後生存率が低いこと、また肝臓転移を伴った大腸がん患者の病理切片において原発巣に比べ、転移巣で有意にmAb FH6の染色性が高いことが報告されてきた。しかしながらmAb FH6が認識すると考えられている糖鎖の末端部分の構造を認識する別の抗シアリルルイスX抗体mAb KM93を用いた大腸がん組織の免疫化学的染色においては、上述のような患者の予後との相関は見られない。また、19種類のヒト大腸がん細胞株を用いたmAb FH6およびmAb KM93によるフローサイトメトリー分析において、mAb FH6では染色されるがmAb KM93では染色されない細胞株が見出された。従って抗シアリルルイスX抗体と呼ばれる抗体が認識する糖鎖は、多様性が存在することが考えられる 【大腸がん細胞株HCT116を用いたmAb FH6が認識する糖鎖の解析】 オリゴ糖の取得-mAb FH6の認識する糖鎖を明らかにするために、mAb FH6の結合性は見られるが、mAb KM93の結合性は見られないヒト大腸がん細胞株HCT116細胞からmAb FH6が認識する糖鎖を分離精製し、その構造を推定した。 HCT116細胞をO-結合型糖鎖の伸長阻害材であるp-nitropheny1-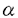 -D-N-acetylgalactosaminide(pNP-GalNAc)および50 -D-N-acetylgalactosaminide(pNP-GalNAc)および50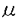 Ciの[3H]-グルコサミンの存在下で培養すると、mAb FH6の結合性が消失すると同時に、培養上清中にpNP-GalNAc上から伸長したオリゴ糖が遊離してくる。培養上清に遊離してきたオリゴ糖をBio-Gel P-2ゲルろ過により分画したところ複数の画分に分かれた。ボイドボリュウム付近に溶出されてきた画分を、更にAmide-80カラムを用いた順相HPLCおよびMono Q陰イオン交換クロマトグラフィーにより分画した。その結果、9種類のオリゴ糖画分を得た。この9種類のオリゴ糖を、mAb FH6をSepharose 4Bに固定化したアフィニティークロマトグラフィーに供したところ3種類のオリゴ糖において、他のオリゴ糖に比べ僅かではあるが溶出の遅れが認められ(図1)、mAb FH6と親和性を持つ事が示された。そこでこの3種類のオリゴ糖の構造を解析する事にした。 Ciの[3H]-グルコサミンの存在下で培養すると、mAb FH6の結合性が消失すると同時に、培養上清中にpNP-GalNAc上から伸長したオリゴ糖が遊離してくる。培養上清に遊離してきたオリゴ糖をBio-Gel P-2ゲルろ過により分画したところ複数の画分に分かれた。ボイドボリュウム付近に溶出されてきた画分を、更にAmide-80カラムを用いた順相HPLCおよびMono Q陰イオン交換クロマトグラフィーにより分画した。その結果、9種類のオリゴ糖画分を得た。この9種類のオリゴ糖を、mAb FH6をSepharose 4Bに固定化したアフィニティークロマトグラフィーに供したところ3種類のオリゴ糖において、他のオリゴ糖に比べ僅かではあるが溶出の遅れが認められ(図1)、mAb FH6と親和性を持つ事が示された。そこでこの3種類のオリゴ糖の構造を解析する事にした。 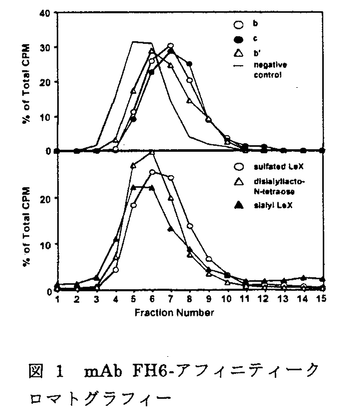 図1 mAb FH6-アフィニティークロマトグラフィー 図1 mAb FH6-アフィニティークロマトグラフィー 構造解析-得られたオリゴ糖をシアリダーゼを用いて脱シアル化した後、MALDI-TOFMSにより分子量を測定したところ、m/z1220、1434および1585であった。これらのオリゴ糖の糖鎖配列を類推するためにMALDI-TOF MSを用いたPost source decay(MS/MS)分析を更に行った。その結果、最初のオリゴ糖は6糖からなる糖鎖で、枝分かれのある構造を持つ事が示唆された。また、3番目のオリゴ糖は、8糖からなり長いポリラクトサミン構造を持つ事が示唆された。しかしながら、2番目のオリゴ糖ではフラグメントイオンが検出されずPSD分析を行う事ができなかった。endo- -galactosidaseによる酵素消化では、3番目の糖鎖のみが切断され、他の2つのオリゴ糖は切れなかった。この結果は、MALDI-TOF MSでの結果を支持するものであった。最後にHPAEC-PADを用いた糖組成分析を行った。その結果、分子量1220および1434のオリゴ糖でのガラクトースおよびN-アセチルグルコサミンの存在比は同一で、同一の骨格を持っている可能性が示唆された。また、これらのオリゴ糖では共にフコースは検出されず、後者のオリゴ糖ではシアル酸も検出されなかった。35Sを用いて、これらのオリゴ糖を代謝標識した結果、分子量1434のオリゴ糖には硫酸残基が含まれている事が示唆された。3番目の分子量1585のオリゴ糖は、組成分析により前者2つのオリゴ糖よりガラクトースとN-アエチルグルコサミンがそれぞれ1残基づつ大きな糖鎖であり、これにはシアル酸およびフコースが含まれている事が示された。Mono Qカラムによる溶出位置の結果と、これらの分析の結果を総合すると図2に示す構造が最も当てはまる事が示された。つまり、mAb FH6の認識には、ラクトサミン構造を含む酸性オリゴ糖が必要であるが、フコースは必ずしも必要でないらしい事が示唆された。 -galactosidaseによる酵素消化では、3番目の糖鎖のみが切断され、他の2つのオリゴ糖は切れなかった。この結果は、MALDI-TOF MSでの結果を支持するものであった。最後にHPAEC-PADを用いた糖組成分析を行った。その結果、分子量1220および1434のオリゴ糖でのガラクトースおよびN-アセチルグルコサミンの存在比は同一で、同一の骨格を持っている可能性が示唆された。また、これらのオリゴ糖では共にフコースは検出されず、後者のオリゴ糖ではシアル酸も検出されなかった。35Sを用いて、これらのオリゴ糖を代謝標識した結果、分子量1434のオリゴ糖には硫酸残基が含まれている事が示唆された。3番目の分子量1585のオリゴ糖は、組成分析により前者2つのオリゴ糖よりガラクトースとN-アエチルグルコサミンがそれぞれ1残基づつ大きな糖鎖であり、これにはシアル酸およびフコースが含まれている事が示された。Mono Qカラムによる溶出位置の結果と、これらの分析の結果を総合すると図2に示す構造が最も当てはまる事が示された。つまり、mAb FH6の認識には、ラクトサミン構造を含む酸性オリゴ糖が必要であるが、フコースは必ずしも必要でないらしい事が示唆された。 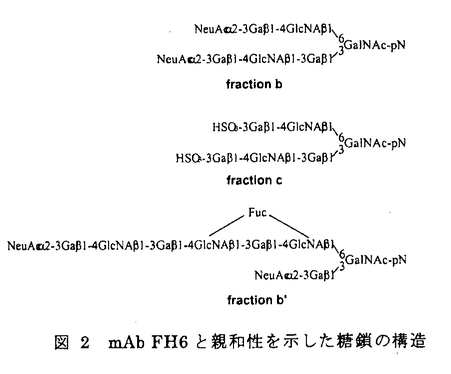 図2 mAb FH6と親和性を示した糖鎖の構造【ヒト大腸がん細胞KM12-HXおよびKM12-LX細胞の産生するmAb FH6が認識する糖鎖の解析】 図2 mAb FH6と親和性を示した糖鎖の構造【ヒト大腸がん細胞KM12-HXおよびKM12-LX細胞の産生するmAb FH6が認識する糖鎖の解析】 HCT116細胞の結果からだけでは、mAb FH6が認識する糖鎖を網羅したとはいえない。そこでmAb FH6との結合性で分離した大腸がん細胞亜株KM12-HXおよびKM12-LX細胞を用いて、mAb FH6と親和性のある糖鎖の構造を明らかにする事にした。mAb FH6高結合性亜株であるKM12-HX細胞は、LX細胞に比べ、マウスでの転移性、浸潤性および肝臓への接着がいずれも高く、臨床での現象のモデルになると思われる細胞株である。 糖鎖の取得と精製-HCT116細胞と同様にO-結合型糖鎖の伸長阻害剤であるpNP-GalNAcおよび[3H]-グルコサミンの存在下で培養するとmAb FH6の結合性が減少する事から、その培養上清中を回収しBio-Gel P-2ゲルろ過により分画した。図3に示すようにKM12-HX細胞からはH0、H1、およびH2の3つの画分を、KM12-LX細胞からはL1およびL2の2つの画分を得た。分取した画分を更にAmide-80順相HPLC、Mono Q陰イオン交換クロマトグラフィーおよび、2度目のAmide-80順相HPLCを行い、精製した。その結果、KM12-HX細胞からはH0-c、H1- 、H1- 、H1- 、H2- 、H2-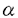 およびH2- およびH2- 画分が、KM12-細胞からはL1- 画分が、KM12-細胞からはL1-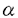 、L1- 、L1- 、L2- 、L2-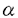 およびL2- およびL2- 画分が得られた(図4)。クロマトグラフィーでの溶出位置から、H1- 画分が得られた(図4)。クロマトグラフィーでの溶出位置から、H1-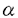 とL1- とL1-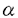 、H1- 、H1- とL1- とL1- 、H2- 、H2-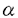 とL2- とL2-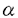 およびH2- およびH2-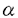 とL2- とL2- は、同一のものと考えられるので、以後の分析はKM12-HX細胞由来の糖鎖を中心に行った。 は、同一のものと考えられるので、以後の分析はKM12-HX細胞由来の糖鎖を中心に行った。  図3 Bio-Gel P-2ゲルろ過 図3 Bio-Gel P-2ゲルろ過 図4 pNP-オリゴ糖の精製 図4 pNP-オリゴ糖の精製 mAb FH6との親和性の検討-フローサイトメトリー分析により、KM12-HXおよびKM12-LXをシアリダーゼ消化するとmAb FH6の結合性は失われることが示されたことから、シアリダーゼ消化して得られるアシアロ糖鎖をネガティブコントロールとした。KM12-HX細胞由来のすべての画分をmAb FH6-Sepharoseにかけ、アシアロ糖鎖の溶出位置と比較した。その結果、H0-c、H1- およびH2- およびH2- の3つの画分が、アシアロ糖鎖に比べ溶出の遅れが見られ、親和性がある事が分かった。その親和性は、特にH0-cおよびH1- の3つの画分が、アシアロ糖鎖に比べ溶出の遅れが見られ、親和性がある事が分かった。その親和性は、特にH0-cおよびH1- で高いことが示された。 で高いことが示された。 構造解析-mAb FH6と親和性があることが示された画分を脱シアル化した後、MALDI-TOF MSおよびPSD(MS/MS)による分析に供した。その結果、H1- およびH2- およびH2- 画分の脱シアル化物は、それぞれ6糖および4糖からなる糖鎖に、フコース残基が1つついたものであることが示唆された。またH0-cは8糖にフコース残基が1つついたものであることが示唆された。これらの結果は、フコシダーゼ消化による分解産物の分析結果からも支持された。次に糖の結合様式を知るために、特異性の異なる 画分の脱シアル化物は、それぞれ6糖および4糖からなる糖鎖に、フコース残基が1つついたものであることが示唆された。またH0-cは8糖にフコース残基が1つついたものであることが示唆された。これらの結果は、フコシダーゼ消化による分解産物の分析結果からも支持された。次に糖の結合様式を知るために、特異性の異なる -ガラクトシダーゼを用いた酵素消化およびスミス分解を行った。その結果、酵素消化により選られた全ての画分は2型糖鎖であることが判明した。また、スミス分解により、全ての画分でシアル酸が、 -ガラクトシダーゼを用いた酵素消化およびスミス分解を行った。その結果、酵素消化により選られた全ての画分は2型糖鎖であることが判明した。また、スミス分解により、全ての画分でシアル酸が、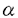 2-3結合でガラクトースに結合しており、2型コアの構造を持つ事を示唆する結果が得られた。以上の事から、得られたmAb FH6と親和性のある画分は、図5に示されるような構造をもつ糖鎖であることが示唆された。この中には、mAb FH6が認識する糖鎖と考えられたフコース残基を2つ含むシアリルルイスX型糖鎖は含まれていなかった。さらに、分取した画分をエンド- 2-3結合でガラクトースに結合しており、2型コアの構造を持つ事を示唆する結果が得られた。以上の事から、得られたmAb FH6と親和性のある画分は、図5に示されるような構造をもつ糖鎖であることが示唆された。この中には、mAb FH6が認識する糖鎖と考えられたフコース残基を2つ含むシアリルルイスX型糖鎖は含まれていなかった。さらに、分取した画分をエンド- -ガラクトシダーゼにより消化を試みたところ、H0-cのみ消化された。 -ガラクトシダーゼにより消化を試みたところ、H0-cのみ消化された。 KM12-HX細胞とKM12-LX細胞が産生する糖鎖の違い-分画して得られた糖鎖画分の相対比を計算した(図5)ところ、KM12-HX細胞とKM12-LX細胞で共通に見られた糖鎖では、mAb FH6と親和性の高い糖鎖の存在比がKM12-HX細胞由来の画分で大きいことが判った。また、mAb FH6と親和性の高いH0-c画分はKM12-HX細胞由来の糖鎖においてのみ検出された。  図5 mAb FH6と親和性を示した糖鎖の構造【結言】 図5 mAb FH6と親和性を示した糖鎖の構造【結言】 HCT116細胞、KM12-HX細胞およびKM12-LX細胞由来のいずれのオリゴ糖からも、以前から報告されてきたmAb FH6のエピトープとされているNeuAc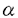 2-3Gal 2-3Gal 1-4(Fuc 1-4(Fuc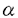 1-3)GlcNAc 1-3)GlcNAc 1-3Gal 1-3Gal 1-4(Fuc 1-4(Fuc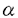 1-3)GlcNAc 1-3)GlcNAc 1-の構造は、検出できなかった。HCT116細胞、KM12-HX細胞およびKM12-LX細胞から得られたmAb FH6と親和性を示す糖鎖の構造から類推すると、mAb FH6との結合にはシアル酸あるいは硫酸残基をもつ酸性ラクトサミン型糖鎖が必要であり、フコース残基は必ずしも必要ではなが、フコースが存在すると親和性が増すらしい。 1-の構造は、検出できなかった。HCT116細胞、KM12-HX細胞およびKM12-LX細胞から得られたmAb FH6と親和性を示す糖鎖の構造から類推すると、mAb FH6との結合にはシアル酸あるいは硫酸残基をもつ酸性ラクトサミン型糖鎖が必要であり、フコース残基は必ずしも必要ではなが、フコースが存在すると親和性が増すらしい。 |