【背景と目的】 必須アミノ酸の一つトリプトファン(Trp)の特徴はインドール環の特性で、その異環性、疎水性、電子供与性、反応性は、蛋白に組み込まれ構造・機能に重要な役割を担う一方、Trpの代謝やその生理的意義に著明な特徴を与える。此のTrp固有の代謝系は、動物では、インドール環構造の保存系と開環系に大別され、前者は5位の水酸化を経て神経伝達物質セロトニン(5-HT)や生理活性物質メラトニンの生合成に連結し、後者は(Fig.1.)、インドール環2-3位間の酸化的開裂を初発とし、キヌレニン(Kyn)に続く多くの中間体を経て、特に肝臓では、ニコチン酸生合成又はアセチルCoAから炭素骨格代謝主要プールに至る長大な代謝系を構成する。此の開環系の枠組みは、非肝臓組織に広く分布する初発酵素、部分代謝系、そして、芳香性・異環性を持つ中間代謝産物自身の生理活性の発見から、変貌した。因みに、本系中間体の金属キレーター作用の指摘は古典的として、3-ハイドロキシキヌレニン(3-OH-Kyn)のリポ蛋白質抗酸化作用、中枢神経系に於ける内在神経活性物質としてのキノリン酸(QA)神経毒性、キヌレン酸(KA)のNMDAレセプターアンタゴニスト作用はトビックで、又,最近のハンチントン病、エイズ、好酸球増多筋肉痛症候群(EMS)などが膀胱癌や肝障害、白内障など古典的命題に加わり,病態と開環系代謝異常との関連に研究と示唆が活発である。此の中間体生理活性の内在性は、部分代謝系・多臓器に拡張された開環系の追求、生合成担当細胞と調節に関する関心を著しく高めた。そして、直ちに、開環系初発反応"Trpからフォルミルキヌレニン(f-Kyn)生成"を触媒する肝トリプトファンピロラーゼ(TPO)、非肝臓組織のインドールアミン2’,3’-ジオキシゲナーゼ(IDO)の、基質Trp・ステロイド(TPO)、LPS・インターフェロン(IDO)による分別誘導の適用により、IDO経由と仮定した脳内QA、KAの産生、活性酸素抵抗性増大などの評価を行う、という様式のアブローチを生んだ。しかし、脳のKyn-3-水酸化酵素活性が検出限界下に関わらず、3-OH-Kynが論じられ、その下流の産物QAが比較的高い事実には、未だに深い疑問が残る。此の疑問とは、外部からの開環系中間体のシャント供給経路の可能性であるが、実際、大臓器間つまり個体水準でも、実は、此の事は明確では無かった。IDO誘導では血中Kynや尿中キサシツレン酸(XA)の増大、肝TPO誘導では両者不変という充分明確な対照の理解も、新しい枠組みの実験事実と論理を要した。以下、開環系中間代謝の多臓器間関連を求めた本基礎研究は、また、細胞単位の微量代謝への拡張に指針を与える事をも目的とする。  Fig.1.Kynurenine pathway of tryptophan Fig.1.Kynurenine pathway of tryptophan そのため、本研究では、初発酵素の律速性を再検討し、アミノ酸代謝において重要な役割をもつ代表的臓器、臓器間をつなぐ内部環境である血漿、そして、特に、開環系中間代謝産物であるKAやXAが大量に含まれる尿も採取し、代謝の総体を最終的な体外排出量として調べ、生体全体系で開環系中間代謝動態を追求した。本研究では、血中前駆体アミノ酸Trpを分解する酵素、トリブトファン側鎖酸化酵素I型(TSO I)をラットに投与し、血中のTrpを1時間以内に迅速特異的に1/100程度まで除去してTrp由来のKyn生合成の急速な遮断/減少による中間代謝の応答を追求することにより、それぞれの臓器相互関連を調べた。さらに、内在TPO/IDOによる代謝律速の解消及びKynの充分な供給を求め、Trpと輸送体を競合するKynの生体負荷を、血中Trp除去後に行い、より明確な開環系中間代謝応答を求めた。そして、その際の臓器/血中Trpの有無と血中中間体及び臓器中間代謝との関連の追求、また、血中Kynプールへの供給臓器、依存性臓器の特定、更に中間代謝の臓器差の評価を同時に試みた。 【実験方法】 7週令のS.D.系の雄ラットを購入し、25℃、湿度50%、明暗周期(8時点灯20時消灯)下で飼育し基本的に8-9週齢で用いた。まず、血液と尿の開環系中間代謝産物の経時変化を同時モニターする実験では、実験前日に代謝ケージに一匹ずつ入れ、一晩絶食させた後に、TSO I(5-20単位)またはTrp(100mg/Kg)、Kyn(100mg/Kg)の単独投与、さらにTSO投与後3.5時間後にKyn投与をし、対照としては生理的食塩水を3又は5ml腹腔内投与し、ヘパリン処理したキャピラリーを用いて尾静脈血と、対応する蓄積尿を1日めは2-4時間ごと、2日め以降は、12時間ごとに採取した。尾静脈血は、遠心分離して血漿を得、0.15%ビロ亜硫酸ナトリウム、0.05%EDTA・2Naを含む0.4 M PCAで除蛋白を行い、尿は、体積を測定後、その一部をとり、等量の0.2 M PCAを加え、遠心後の上清をサンプルとした。また、臓器の開環系中間代謝産物の経時変化を追求する実験では、上記と同様の腹腔内投与を行い、経時的に断頭して頚血、脳、肝臓、腎臓、精巣上体、精巣、肺、十二指腸、空腸、回腸、大腿筋を採取し、ポリトロンでホモゲナイズし、上記還元剤入りPCA溶液で除タンパク後の抽出液をサンプルとした。開環系代謝産物測定は、逆相高速液体クロマトグラフィー(HPLC)により,電気化学検出器・紫外部吸収モニター・蛍光モニターを単独又は多重で用い、分離定量した。臓器の各物質の濃度は組織湿重量当たりで求め、尿については、クレアチニン濃度をJaffe反応により定量し、クレアチニン当たりの濃度として示した。さらに、TSO投与によるKyn-3-水酸化酵素に対する酵素活性の影響を調べるため、肝臓と腎臓のミトコンドリア画分をとり、基本的にCarpendo et al.(1994)の方法を用いてKynを基質とし、3-OH-Kynの生成量をHPLCを用いて測定して活性を求めた。また、比較のため、ミトコンドリアのマーカー酵素であるコハク酸脱水素酵素(SDH)の活性をPMSを介するMTTの還元を570nmで追跡することにより測定した。用いたTSOはTakai et al.(1987)の方法に基づいたNakamaru et al.(in preparation)の改良法により、Kg単位のPseudomonas(ATCC29574)からg単位をSDS-PAGEで95%の純度に大量精製し、-80℃保存したものを用いた。 【結果】 トリプトファン(Trp)分解酵素TSOIの生体投与による尾静脈血と尿の開環系中間代謝応答の同時追跡:TSOI10単位の投与により、血漿のTrpは、投与後1.5時間で正常の約5%以下にまで急速に減少、以後10%以下の低水準を24時間維持し、その後徐々に回復、66時間後に50%まで回復した。血漿のKynは、約2時間のlagの後,Trpの減少に遅れ、投与後4時間半で30-40%とより緩やかに減少し、投与後10時間以降に10%の最低水準に達し、約30時間までその低水準を保ち、以後Trpの回復に平行して、Trp同様に66時間後に50%まで回復した。一方、尿中のKAとXAは、血中Kynの減少よりも少し遅れ、投与後3-6時間の間に減少を開始し、12-24時間でKAは20%以下、XAは15%以下の最低水準に達し、その後緩やかに回復に向かった。血漿Trp及び尿中のKA、XAについては、減少/回復パターンや最低水準の程度は、投与量依存的であったが、血漿Kynの減少/回復パターンの投与量依存性は明確ではなかった。また、KAとXAの間には代謝的時間差は表出せず、この経過において同様な減少、回復パターンを示した。 TSO生体投与による臓器開環系中間代謝応答の結果:臓器環境を取り巻く血中Trpの枯渇で供給を断たれた各臓器Trpレベルの応答差は大きく、TSOI20単位の投与により、腎臓、肝臓、精巣上体、肺の順でTrp除去の程度が低く、7-12時間後に,それぞれ0timeの38、19、15、2.9%の最低水準に達し、その後、腎臓、肝臓では、投与72時間後に正常レベルに、肺は50%まで回復したが、精巣上体の回復は遅く30%にとどまった。一方、Kynは精巣上体と肺での減少速度はTrpに平行し、正常値の20-30%まで、減少した。肝臓、腎臓では2時間のlag timeで減少を開始し、それぞれ、6、12時間後に正常の20、40%に達したが、その程度が少ないことは、臓器Trpの残存が多いことに由来すると考えられる。注目すべきは、Kynの臓器濃度差が大きかったにもかかわらず、Trp除去後は精巣上体を除く多くの臓器Kynが約0.5nmol/gに平均化したことで、血流を介して、Kynが臓器間で平衡状態に達するという概念がTrp除去下で引き出されたことである。Kynレベルはこれらすべての臓器で72時間後には正常と同水準に回復、肝臓では正常の3倍に及ぶreboundを示した。臓器KAは測定した限りでは、肝臓、精巣上体で減少、腎臓、肺では変化は小さく、血漿では無変化で、むしろ、正常値の揺動が大きかった。 Trp、Kyn負荷後の血漿、尿中Kyn代謝の経時変化:Trp100mg/kgの単独投与で、血漿Kynは正常の2-3倍、尿中KA、XAは正常レベルでそれぞれ、0.59±0.13、0.65±0.19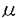 mol(平均±標準偏差)で、開環系中間代謝に及ぼす影響は小さかったのに対し,Kyn100mg/kgの単独投与は、血漿Kynは1時間後に55倍,100 mol(平均±標準偏差)で、開環系中間代謝に及ぼす影響は小さかったのに対し,Kyn100mg/kgの単独投与は、血漿Kynは1時間後に55倍,100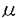 Mを超え、尿中のKA、XAも0-3時間で51、33倍の急激な上昇を示し、投与後12時間のKA、XAの尿中への排出量はそれぞれ7.22±2.26 Mを超え、尿中のKA、XAも0-3時間で51、33倍の急激な上昇を示し、投与後12時間のKA、XAの尿中への排出量はそれぞれ7.22±2.26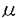 mol、3.50±0.84 mol、3.50±0.84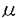 molその比は約2で、対照の1.46より高かった.このKyn投与で血漿Trpの濃度を一過性に定常の60%にまで鏡像的に減少が観察されたのは特記に値する。 molその比は約2で、対照の1.46より高かった.このKyn投与で血漿Trpの濃度を一過性に定常の60%にまで鏡像的に減少が観察されたのは特記に値する。 Trp除去のKyn負荷による血中/臓器/尿の開環系代謝の変化:TSOI20単位を3時間半前に前投与したラットにKyn100mg/kgを負荷すると、血漿TrpはTSO単独投与時と同様の変化を示したが、血漿KynはKyn投与の4.5時間後までは、Kyn単独投与と同様であったが、9時間後には正常水準よりも下がり始め、TSO単独投与時の枯渇レベルへ減少した。尿中のKA、XAは、Kyn投与後0-3時間でそれぞれ、30倍、13倍となり、12時間後以降は、正常の50%からやや低いレベルで平衡を保った。Kyn投与後12時間のKAとXAの尿中への排出量は、10.87±5.42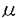 molと3.53±2.05 molと3.53±2.05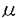 molとなり、KA排出量は生食を前投与した対照のKyn負荷結果、KA、3.64±0.41 molとなり、KA排出量は生食を前投与した対照のKyn負荷結果、KA、3.64±0.41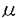 mol、XA、3.01±0.58 mol、XA、3.01±0.58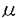 molと比較し、KAは3倍に上昇、XAが20%増で、KA/XA比は対照の1.2、Trp除去の0.93、無投与の1.46に対して、3.2と顕著に上昇した。Kyn負荷3時間半前の生食前投与の効果は明確で(KA/XAが1.46から1.2へ減少)、これは、Trp/Kynの輸送体機構はNa+非依存性との報告があることから、むしろ腹腔注射のストレスの影響と考えられた。また、血中Trp除去時の中間体Kyn負荷の臓器応答としては、基本的に臓器Kyn濃度は、負荷2時間後の精巣上体で対照の60%、回腸で、70%に減少しているほかは、Kyn負荷2、5時間後とも対照とほぼ同濃度であった。それに対してKA濃度は、負荷2時間後の肺、十二指腸、空腸でそれぞれ対照の3.4倍、3.9倍、17.8倍と大きく上昇し、XA濃度も平行して上昇していたが、肝臓、腎臓、筋肉等Kyn主要代謝臓器のKA、XAは、対照と変わらず、この際の肝臓、腎臓Trpの除去は浅く、またTyrは測定した全ての臓器で基本的に変化がなかった。以上の如く、Trp除去下では臓器特異的な代謝応答が明瞭に観察された。TSO+Kyn投与において、尿中代謝産物KAの排出増加がXAの前駆体3-OH-Kynの減少、すなわちKynを3-OH-Kynに転換するKyn-3-水酸化酵素阻害に由来する可能性を考え、ミトコンドリア分画を得、活性を測定したがKyn負荷の2、5時間後で肝臓は対照の94、81%で、腎臓は共に100%保持し、大きな変化はなかった。 molと比較し、KAは3倍に上昇、XAが20%増で、KA/XA比は対照の1.2、Trp除去の0.93、無投与の1.46に対して、3.2と顕著に上昇した。Kyn負荷3時間半前の生食前投与の効果は明確で(KA/XAが1.46から1.2へ減少)、これは、Trp/Kynの輸送体機構はNa+非依存性との報告があることから、むしろ腹腔注射のストレスの影響と考えられた。また、血中Trp除去時の中間体Kyn負荷の臓器応答としては、基本的に臓器Kyn濃度は、負荷2時間後の精巣上体で対照の60%、回腸で、70%に減少しているほかは、Kyn負荷2、5時間後とも対照とほぼ同濃度であった。それに対してKA濃度は、負荷2時間後の肺、十二指腸、空腸でそれぞれ対照の3.4倍、3.9倍、17.8倍と大きく上昇し、XA濃度も平行して上昇していたが、肝臓、腎臓、筋肉等Kyn主要代謝臓器のKA、XAは、対照と変わらず、この際の肝臓、腎臓Trpの除去は浅く、またTyrは測定した全ての臓器で基本的に変化がなかった。以上の如く、Trp除去下では臓器特異的な代謝応答が明瞭に観察された。TSO+Kyn投与において、尿中代謝産物KAの排出増加がXAの前駆体3-OH-Kynの減少、すなわちKynを3-OH-Kynに転換するKyn-3-水酸化酵素阻害に由来する可能性を考え、ミトコンドリア分画を得、活性を測定したがKyn負荷の2、5時間後で肝臓は対照の94、81%で、腎臓は共に100%保持し、大きな変化はなかった。 【考察】 本研究では、Trp開環代謝系(Kyn経路)の生体全体系における調節機構の基礎的かつ未知の枠組みを探究するため、基質Trpの除去やTrp/Kyn負荷及びTrpの除去後のKynのシャント負荷により、それぞれの臓器応答、多臓器間相互関連を調べた。その際、実験的には、Trpを特異的に分解し、血中の半減期(tl/2=12h)が異例に長い酵素、TSOIを腹腔内投与し、血中のTrpを1時間以内に迅速特異的に1/100程度まで除去するアプローチで達成し、血中Kynプールへの供給臓器、依存性臓器の特定やKyn生合成の急速な遮断/減少による臓器中間代謝応答の臓器差の評価も同時に試みた。 TSOIの投与により、血中Trpの枯渇で血流からの供給を断たれた際の各臓器Trpレベルの減少の程度と時間経過の臓器差は大きかった。腎臓や肝臓では、臓器Trpの減少の程度が浅く回復も早く、自身の蛋白分解によるTrp供給能力の存在が推定された。一方、精巣上体や肺ではTrpの減少の程度が深く回復も遅かったため、これらの臓器ではTrp代謝回転速度は早く、臓器内Trpの殆どを血中Trpに依存していることが示唆された。また、Trp除去に伴う臓器Kyn減少経過は4段階:約2時間のlag、急速な減少、緩徐な減少、回復期に分別され、貯蔵プールの大きさがlag timeに反映されたが、極値と減少回復パターンは基本的にどの臓器でも類似し、Trp枯渇時の血液を介したKyn自身のスムーズな臓器間授受の可能性が強く示唆された。特に,血漿KynはTSO投与後の血漿Trpの急激な減少後、2-3時間のlag timeを示しながら著明な減少パターンを示すことから、血漿Kynは基本的に血漿Trp濃度に依存する事、そして、その減少パターンが、臓器Kyn、特に肝臓や精巣上体Kynに平行していることから、血漿Kynの減少が臓器からのKyn供給の減少、迅速平衡の反映であることが示唆された。またさらに下流の尿中排出物KA、XAは血漿Kynの減少と平行し、かつ著明な減少の経時変化の結果が得られ、最終個体代謝の総和である尿中KA、XAは生体内開環系代謝平衡状態を強く反映していることが、明確となった。 血漿Trp除去後のKyn投与でKAの尿中排出が3倍に増大したことは、対照よりも早いKyn代謝・消去機構の作動を示す。生理的なKAの主要産生臓器、肝臓・腎臓でKAは対照と変わらず、小腸、肺でKAが著明に増大し、尿中のKA増加には小腸KA増大が深く関与する事が強く示唆された。これらの臓器では、XA生成に関与するKyn-3-水酸化酵素活性が腎臓、肝臓の約1%と低く、Trp除去による輸送体競合解消に基づく小腸、肺のKyn取り込み増加及び自身のもつ高いトランスアミナーゼ(TA)活性によるKA産生増加の可能性は充分である。小腸、肺での相当量のXA蓄積に関しては、XA自身の取り込み、前駆体3-OH-Kyn取込み増大とTAによるXA産生、両者の可能性が示唆され、またその著明な蓄積が、むしろ腎臓経由の尿中XA排出増大を抑制した可能性も考えられた。以上は、血中Trp濃度自身が、開環系の下流に位置するKynの臓器代謝に強く影響を及ぼすことを示し、更に、Kyn、KA、XAの臓器間shufflingの可能性が、Trp除去条件下ではじめて明確に示された。 本研究により、酵素生体投与による血中Trpの迅速特異的除去のアプローチは、既に確立した脳内5-HT系の研究のみならず、開環系代謝の研究にも大変有用であることが明らかとなった。また、Trpは無論、Trp開環系代謝産物も産生臓器から血中へ放出され、非産生臓器は血中から取り込みさらに下流の代謝基質として用いる此の中間体shuffling、再分布機構は、生体全体系では多臓器間関連として今後は細胞間関連に考慮すべき高次代謝機構であることが提唱された。 |