| 内容要旨 | | ポリオウイルスは、小児麻痺の病因として知られているウイルスである。ゲノムは全長約7500塩基よりなる1本のプラス鎖RNAである。このRNAは、ポリオウイルスの細胞への侵入後、mRNAとして機能する。RNAの5’末端にはキャップ(Cap)構造が存在せず、蛋白質合成は、リボゾームがRNAの内部に存在する塩基配列IRES(internal ribosomal entry site)にエントリーすることにより開始する。したがって、多くの細胞側mRNAで観察されるキャップ構造依存的翻訳開始機構とは異なる機構により開始される。ポリオウイルスの蛋白質の前駆体は、そのRNA上に存在する唯一のオープンリーディングフレームにポリ蛋白質としてコードされており、翻訳されながら、自分がコードするプロテアーゼ2Apro、3Cpro、および3CDproにより切断(プロセス)を受け、機能を持つポリオウイルス蛋白質となる。 ポリオウイルス感染細胞内では細胞側mRNAからの翻訳は阻害されることが知られている。キャップ構造をもつ細胞側mRNAの翻訳開始に必須の開始因子eIF4Gが、2Aproを介して切断を受けることがその主要な原因と考えられている。その間もポリオウイルスIRESからの翻訳は進行するので、eIF4Gの切断はIRES依存的翻訳開始には影響を与えないと考えられる。 最近、次々と、IRESを持つ細胞側mRNAの存在が報告されている。それらの中には本研究で使用したBip(immunoglobulin heavy-chain binding protein or glucose-regulated protein[GRP78])mRNAやeIF4G mRNAも含まれている。これらmRNAはIRESを持つため、ポリオウイルス2Aproによる翻訳阻害を受けない可能性がある。本研究では、2Apro発現細胞における、IRESを持つ細胞側mRNAの翻訳効率を解析することを目的とした。 この目的のためにポリオウイルス2AproをコードするcDNAを持つHeLa S3細胞を樹立した。この細胞内での2Apro発現はCreリコンビナーゼを発現するリコンビナントアデノウイルス(AxCANCre)を感染させることによりコントロールすることができる。この形質転換HeLa S3細胞においては、AxCANCre感染後6時間からeIF4Gの切断が観察され、この時間は細胞側蛋白質合成阻害の時間と一致していた。なお、発現した2Aproは細胞質に局在していた。 上記発現系を使用し、Creリコンビナーゼによる2Apro発現が,IRESを持つBip mRNAやeIF4G mRNAからの翻訳も阻害することを明らかにした。しかしながら、Bip mRNAおよびeIF4GIImRNAからの翻訳阻害効率は,IRESを持たないeIF4AやeIF4EのmRNAからの翻訳阻害の効率には及ばないことが判明した。この結果はHeLa細胞内ではIRESを持つmRNAも通常は部分的にキャップ構造依存的に翻訳されている可能性を示唆するものである。しかしながら、これらmRNAのIRESの活性発現はポリオウイルスIRESとは異なり、活性発現のための生体分子としてeIF4Gを要求している可能性も考えられる。 そこで、Bip IRESおよびポリオウイルスIRESを2つのシストロンの間に挿入したジシストロニックmRNAに相当するcDNAを構築し、これらを上記形質転換HeLa細胞にトランスフェクションした。この細胞にAxCANCre感染させることにより、Bip IRESおよびポリオウイルスIRESの活性に与える2Aproの影響を解析した。その結果、2AproはポリオウイルスIRESのみではなく、Bip IRES活性にも影響を与えないことが判明した。即ち、HeLa細胞のIRESを持つmRNAは通常は、完全にIRES依存的ということではなく、ある程度、キャップ構造依存的に翻訳されていることが強く示唆された。 |
| 審査要旨 | | 本研究はポリオウイルスプロテアーゼ2Aproを単独で細胞内発現させ,その細胞に与える影響,とくに細胞側mRNAからの翻訳開始効率に対する影響を解析したものである。 ポリオウイルス感染細胞内では,ポリオウイルスプロテアーゼ2Apro機能により,翻訳開始因子eIF4Gが切断を受け,この翻訳開始因子を必要とするキャップ構造依存的翻訳開始が阻害され(いわゆるShut-off現象),細胞側蛋白質は合成できなくなる。一方,ポリオウイルスmRNAからの翻訳は,そのRNAに存在するIRESと呼ばれる構造にリボゾームがエントリーすることにより開始され,eIF4Gが切断された状態でも進行する。 以上のような背景を踏まえ,洪徳憙は細胞側にも存在するIRESを持つmRNAからの翻訳開始が2Aproにより阻害されるか否かを解析した。主な結果は以下のとおりである。 1)ポリオウイルスの2AproをコードするcDNAを持つHeLa S3細胞を樹立した。この2AprocDNAの発現は,Cre-loxP系により制御されており,Creリコンビナーゼを発現するアデノウイルス(AxCANCre)を感染させることにより発現させることができる。形質転換HeLa S3細胞においては,AxCANCre感染後6時間からの切断が観察され,この時間は細胞側蛋白質合成阻害の時間と一致していた。AxCANCreの感染による細胞mRNA合成への影響は見られなかった。 2)この発現系で2Aproを発現させた結果,樹立した形質転換HeLa S3細胞は2Aproの発現に伴い細胞の形が丸くなり,接着性を失った。変異を導入した2AproをコードするcDNAを持つHeLa S3細胞は2Aproの発現によっては細胞の形の変化は起こらないので,この現象は2Apro発現がもたらすものであることが示唆された。 3)2Apro発現細胞における,細胞側mRNAの翻訳効率を調べた結果,RNAの5’末端側にIRESを持つmRNA,すなわちBip(immunoglobulin heavychain binding protein or glucose-regulated protein[GRP78])mRNAやeIF4G(eukaryotic initiation factor 4G)mRNAからの翻訳も2Apro発現により阻害されることを明らかにした。しかしながら,Bip mRNAおよびeIF4GII mRNAからの翻訳阻害効率は,IRESを持たないeIF4AやeIF4EのmRNAからの翻訳阻害の効率には及ばないことを示した。この結果はHeLa細胞内ではIRESを持つmRNAも通常は部分的にキャップ構造依存的に翻訳されている可能性を示唆するものである。しかしながら,細胞側IRESの発現にはeIF4Gが必要である可能性が残されている。そこで,Bip IRESおよびポリオウイルスIRESを2つのシストロン(クロランフェニコールアセチルトランスフェラーゼと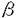 -galコーヂング配列)の間に挿入したジシストロニックmRNAに相当するcDNAを構築し,これらを上記形質転換HeLa細胞にトランスフェクションした。この細胞にAxCANCreを感染させることにより,Bip IRESおよびポリオウイルスIRESの活性に与える2Aproの影響を解析した結果、2AproはポリオウイルスIRESのみではなく,Bip IRES活性にも影響を与えないことが判明した。 -galコーヂング配列)の間に挿入したジシストロニックmRNAに相当するcDNAを構築し,これらを上記形質転換HeLa細胞にトランスフェクションした。この細胞にAxCANCreを感染させることにより,Bip IRESおよびポリオウイルスIRESの活性に与える2Aproの影響を解析した結果、2AproはポリオウイルスIRESのみではなく,Bip IRES活性にも影響を与えないことが判明した。 以上のように,本論文では2Aproの発現が,細胞の形態変化をもたらすことを初めて見い出し,さらにHeLa細胞内ではIRESを持つmRNAも通常は部分的にされている可能性を初めて示唆した。 この結果は分子生物学,ウイルス学のみならず,その応用的な領域に重要な貢献をなすと考えられ,学位の授与に価するものと考えられる。 |