本研究は心筋組織において多彩な役割を持つ一酸化窒素(NO)を産生する一酸化窒素合成酵素(NOS)が心筋細胞死と如何に関わるかを、研究1では遺伝子導入のモデルで、研究2ではイソプロテレノール負荷による心筋障害モデルで解析を試みたものであり、下記の結果を得ている。 1、HVJ-リポソーム法を用いて、ラットの生体心筋にレポーター遺伝子(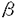 -gal遺伝子)のみならず、病態生理的に意味のある内皮型一酸化窒素合成酵素(ecNOS)遺伝子の導入に成功し、蛋白発現の局在が免疫組織学的に示された。その蛋白発現は導入後3日目より確認され、7日目に最大となり、その後漸減して14日目まで認められた。最大発現時のX-gal染色範囲は左室自由壁横断面の12%に達した。 -gal遺伝子)のみならず、病態生理的に意味のある内皮型一酸化窒素合成酵素(ecNOS)遺伝子の導入に成功し、蛋白発現の局在が免疫組織学的に示された。その蛋白発現は導入後3日目より確認され、7日目に最大となり、その後漸減して14日目まで認められた。最大発現時のX-gal染色範囲は左室自由壁横断面の12%に達した。 2、ecNOS遺伝子と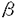 -gal遺伝子をco-transfectionした部位では、光顕で広範囲に心筋細胞の縮小化・変性・壊死・線維化が示された。この心筋障害部位と正常部位の境界は明瞭であった。縮小した心筋細胞にはco-transfectionした -gal遺伝子をco-transfectionした部位では、光顕で広範囲に心筋細胞の縮小化・変性・壊死・線維化が示された。この心筋障害部位と正常部位の境界は明瞭であった。縮小した心筋細胞にはco-transfectionした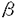 -gal活性染色がされる細胞とされない細胞が存在し、その形態は紡錘型を呈した。co-transfectionするecNOS遺伝子量を1/10にすると、用量依存性に心筋細胞の縮小化・変性・壊死所見ともに減少した。特異抗体を用いた免疫組織染色でecNOS蛋白は心筋細胞障害部位の周辺に確認された。同様の心筋細胞障害はecNOS遺伝子単独導入でも観察され、L-NAMEの前処置ラットではecNOS遺伝子を導入しても心筋障害は出現しなかった事より、ecNOS過剰発現によるNOを介した心筋細胞死が示唆された。 -gal活性染色がされる細胞とされない細胞が存在し、その形態は紡錘型を呈した。co-transfectionするecNOS遺伝子量を1/10にすると、用量依存性に心筋細胞の縮小化・変性・壊死所見ともに減少した。特異抗体を用いた免疫組織染色でecNOS蛋白は心筋細胞障害部位の周辺に確認された。同様の心筋細胞障害はecNOS遺伝子単独導入でも観察され、L-NAMEの前処置ラットではecNOS遺伝子を導入しても心筋障害は出現しなかった事より、ecNOS過剰発現によるNOを介した心筋細胞死が示唆された。 3、ecNOS遺伝子導入で出現した心筋細胞障害部位では、縮小細胞やTUNEL陽性細胞が検出され、電顕では細胞膜や核膜の形態は保持されていたが、アポトーシスに典型的な核の断片化やクロマチンの凝縮像は検出されなかった。 4、イソプロテレノール負荷により、心内膜下に局所的な心筋障害が出現し、多数のED-1陽性マクロファージ浸潤を認めたが、この障害部位では免疫組織学的にTNF-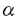 ・iNOS・ニトロチロシンが、マクロファージを含む浸潤細胞と周辺の心筋細胞に観察された。 ・iNOS・ニトロチロシンが、マクロファージを含む浸潤細胞と周辺の心筋細胞に観察された。 5、同障害部位でDNA断片化の存在を示すTUNEL染色陽性細胞を認め、CPP-32陽性浸潤細胞を確認し、更に免疫二重染色法により、心筋及びマクロファージのTUNEL陽性細胞はニトロチロシン陽性マクロファージの周囲に観察された。TUNEL陽性心筋細胞は壊死部位と正常心筋細胞の境界領域に散在し、細胞膜の破壊は認めず正常細胞形態を保ち、アポトーシス様心筋細胞死と考えた。これらの組織学的変化はマクロファージの浸潤を含めてL-NAMEの前投与により抑制され、NOを介した心筋細胞死が示唆された。 以上、本論文はラットの生体心筋内に効率良くecNOS遺伝子を導入してecNOSの過剰発現を伴った心筋細胞死の存在を示し、更にイソプロテレノールによる心筋障害でiNOSの誘導を伴った心筋細胞死の存在を示した事により、生体心筋への遺伝子導入と、NOを介したアポトーシス様細胞死を含む心筋細胞死の解明に重要な貢献をなすと考えられ、学位の授与に値する。 |