| 審査要旨 | | 本学位論文の題目は,「ヒト線維芽細胞の長期培養により形成される真皮様構造体に関する研究」である。ヒトなど,体重の大きい動物においては,細胞間を充填する細胞外マトリックスは単に細胞の接着をしているだけでなく,組織の骨格構造をなし,さらには細胞の増殖・分化機能にも関わる,固相の機能制御因子として作用している.分子生物学の発展で,多くの生体分子の機能が格段に理解できるようになり,細胞外マトリックスを構成する成分の分子についても,多様な構造成分が発見されてきている.骨形成不全症のようにI型コラーゲン分子(ヒトなど大きい動物の細胞外マトリックスの中でも最も量の多い分子)の変異と臨床症状とのリンクが明らかにされてきたのも分子生物学の手法が応用された成果である.しかし,細胞外マトリックス成分分子は生体組織の固相成分へと沈着して,会合体として生体成分としての機能を果たしている.分子の沈着される機構についての研究は未開拓の分野であり,これは方法論的にさまざまな制約があることもその一因である. 学位申請者はこのような研究の発展段階において,分子構造と臨床症状の間の関係を埋めるための方法として,先行研究で報告されている,線維芽細胞をアスコルビン酸リン酸(ビタミンCの誘導体)存在下で長期培養することで得られる,皮膚真皮に類似の構造体を用いることにした.アスコルビン酸は、I型コラーゲンの合成を促進することが知られており、また、線維芽細胞により蓄積した成分のペプシン処理抽出物の分析からアスコルピン酸存在下で蓄積したI型コラーゲン量が、非存在下の数十倍であるという結果が得られていることから、真皮様構造体はI型コラーゲンが主体であると考えられてきた。学位論文においては,ヒト線維芽細胞のアスコルビン酸リン酸存在下で線維芽細胞を長期間培養することにより形成される真皮様構造体とこの構造体形成に関わる要因について,従来からの検討をさらに詳細に,深めるべく実施された.研究開始の当初から当面する問題を慎重に解決していく過程で,いくつも新知見が得られた.それらをもとに,真皮様構造体の構造,形成に関わる要素について従来想定されえなかった面へも,展開した内容を含む研究成果である. 本学位論文は3章からなる.第1章では,アスコルビン酸存在下の長期間培養で形成した真皮様構造体を構成する成分について,I型コラーゲンと他のマトリックスタンパク質成分との量比を検討している。従来の研究報告では生成された真皮様構造体の中のコラーゲンらせんを有する成分の分析にペプシン処理が用いられている.ペプシン処理の方法では,構造体が完全に可溶化されない上,マトリックスタンパク質成分やペプシンにより切断をうけやすいコラーゲンはぺプシンにより分解を受けるため,真皮様構造体を構成する成分がどのような組成であるのか解析されない.また、骨形成不全症患者由来線維芽細胞が産生するI型コラーゲンはペプシンにより分解を受けやすいとの報告もあり,I型コラーゲンの可溶化による定量としても問題が残る.そこで,真皮様構造体の構成タンパク質成分をペプシン処理を用いないで溶かしだして分析することを考案した。すなわち,コラーゲンの架橋形成に関与するりジルオキシダーゼを阻害する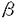 -アミノプロピオニトリルを培地に添加して線維芽細胞を長期間培養して真皮様構造体を形成し,SDSと尿素を含む中性溶液中で熱処理を施し,構造体中のジスルフィド結合以外の共有結合を全く切断せずに,完全に構成成分を溶媒中に分散させることに成功した。抽出物の還元条件でのSDS-PAGEの結果、主だった量のポリペプチド鎖は全て5%アクリルアミドゲル内に展開されており,真皮様構造体の構成タンパク質成分の分析が可能となった。真皮様構造体には、ペプシン処理によっては検出されなかった多数の成分が検出された。その中でも、還元条件のSDS-PAGEで,140kに移動するバンドはI型コラーゲンの -アミノプロピオニトリルを培地に添加して線維芽細胞を長期間培養して真皮様構造体を形成し,SDSと尿素を含む中性溶液中で熱処理を施し,構造体中のジスルフィド結合以外の共有結合を全く切断せずに,完全に構成成分を溶媒中に分散させることに成功した。抽出物の還元条件でのSDS-PAGEの結果、主だった量のポリペプチド鎖は全て5%アクリルアミドゲル内に展開されており,真皮様構造体の構成タンパク質成分の分析が可能となった。真皮様構造体には、ペプシン処理によっては検出されなかった多数の成分が検出された。その中でも、還元条件のSDS-PAGEで,140kに移動するバンドはI型コラーゲンの 2(I)鎖とタンパク質染色強度が同程度であった。生化学的分析から,これは 2(I)鎖とタンパク質染色強度が同程度であった。生化学的分析から,これは 1(VI), 1(VI), 2(VI)であると結論した。VI型コラーゲンが真皮様構造体の主要成分であることは新規の発見である. 2(VI)であると結論した。VI型コラーゲンが真皮様構造体の主要成分であることは新規の発見である. 第2章では,第1章での成果に基づき,線維芽細胞の長期培養で形成される真皮様構造体におけるアスコルビン酸リン酸の意義を検討した.アスコルビン酸添加により,I型コラーゲンおよびVI型コラーゲンのどちらのコラーゲンも細胞層への沈着が増大した結果,真皮様構造体が形成されるものと推定される.しかし,アスコルビン酸により,I型コラーゲンの合成・沈着量は数十倍増えているのに対し、VI型コラーゲンは3倍程度しか増えたのみである.アスコルビン酸の効果はI型コラーゲンとVI型コラーゲンとでは見かけ上,大きな差があった.アスコルビン酸リン酸が遺伝子の発現量をはじめ細胞によって合成・分泌される量を高める効果の他に,I型コラーゲンの場合,分泌された前駆体プロコラーゲンをコラーゲンへ転換することを促進する可能性がある.プロコラーゲンからコラーゲンヘの転換に関与するプロセシング酵素の一つCプロテイナーゼの合成・分泌さらには活性化はアスコルビン酸によって促進されることが知られている.したがってI型コラーゲンの蓄積へのアスコルビン酸の効果は二次的な作用の結果である可能性もある.そうであるならば,アスコルビン酸添加によるI型コラーゲンの蓄積量の促進においては,細胞培養の時間経過において,VI型コラーゲンの蓄積の時間経過より遅れることもありうると予想されたので,蓄積されてくるI型コラーゲンとVI型コラーゲンの量比を培養時間経過とともに追跡した.その結果,培養初期でI型コラーゲが未だあまり蓄積されていない時期に,すでにVI型コラーゲンの蓄積量は高いことがわかった。VI型コラーゲンとI型コラーゲンとでは、アスコルビン酸による蓄積量の増大効果が見かけ上異なるのは、I型コラーゲンの場合は分泌されたプロコラーゲンが蓄積される過程がアスコルビン酸により亢進されたためとの新しい解釈が妥当と思われる.アスコルビン酸はビタミンCとしてよく知られているが,これまで,コラーゲンらせん構造の安定性に必要なプロリンの水酸化反応に関与するプロリルヒドロキシラーゼの活性を安定化する作用以外にははっきりした作用機構が明らかになっていない.本学位論文において,それ以外の作用があり得ることを支持する結果が得られた. 第3章では骨形成不全症患者由来線維芽細胞を用いて.正常な線維芽細胞の場合と比較し,真皮様構造体の形成能およびI型コラーゲンからなる線維会合体の量的,質的違いを検討した.骨形成不全症患者の骨が骨折し易いなどの異常があるが,皮膚等の軟組織(I型コラーゲンが主成分と言われている)での異常ははっきり分かっていない.本学位論文では,2種類の骨形成不全症患者由来線維芽細胞(OIK-74,OIK-130)を用い,アスコルビン酸存在下での長期培養を行い,健常者由来の皮膚線維芽細胞と比較した.どちらの患者由来の細胞でも健常者由来線維芽細胞の形成した真皮様構造体と巨視的には差がない真皮様構造体が形成された。第1章で行った方法を用いて真皮様構造体の成分の分析を検討した.一方の患者由来線維芽細胞つ(OIK-74)では、健常者由来線維芽細胞とI型コラーゲン量に差がなかった.I型コラーゲンの変異が蓄積量に影響しないことがあることが判明した.この患者の臨床症状は比較的マイルドである.他方(OIK-130)では、I型コラーゲン量は1/2程度に減少していた。この患者の臨床症状は重篤で,誕生前後に亡くなっている.真皮様構造体の抗I型コラーゲンポリクローナル抗体の免疫染色では、OIK-74では健常者と変わらず.OIK-130では不定形の凝集物が散在していた。電子顕微鏡による観察では、OIK-130は、他の2つの細胞に比べて横紋のある線維の検出頻度が極端に低かった。OK-130では、蓄積したI型コラーゲンが量的にも質的にも、健常者のものと異なっていた。I型コラーゲンの変異の位置と臨床症状とは,多数の研究にも関わらず,解釈ができていないままの状態で,研究はいわば暗礁に乗り上げている.本学位論文では二例でのみの検討ではあるが.長期に培養し,細胞が蓄積したI型コラーゲンの量的,質的な差が臨床症状とが関係がありうるという新しい視点が示唆された.蓄積するI型コラーゲンの量と質が分子の変異の位置とどのように関係するかは今後のより詳細な検討により可能に思われる.分子と臨床症状が会合体構造を介して,これまで,乗り越えられなかった壁を越えられる道を示唆している. 本学位論文で明らかにされたことの中で,特筆すべきことは,線維芽細胞のアスコルビン酸存在下,長期培養により形成した真皮様構造体の主要構成成分としてはじめてVI型コラーゲンが存在することを発見したことである.この結論は今後の細胞外マトリックス構造および機能に対し,さまざまな新しい展開の出発点を提供すると思われる.例えば,真皮様構造体が有する特別な機能として,糖尿病潰瘍への貼付により治癒効果が知られ,イギリスにて開発されている.なぜ良いのかは議論が不十分である.VI型コラーゲンが主成分であることが糖尿病潰瘍の治癒に有効との可能性もある. 以上のように,本学位論文は将来へもつながる新しいコンセプトを与えるような成果であり,審査委員会は羽関典子氏の提出した学位論文に対し,博士の学位に相応しいものと判断した. |