産業保健および環境領域分野の有害物質と癌遺伝子ならびに癌抑制遺伝子と呼ばれる遺伝子との変異の関係が報告されるようになってきた。例えば、アフラトキシンによる肝臓癌、塩化ビニルによる肝血管肉腫、ラドンによる肺癌などでp53癌抑制遺伝子(以下、p53)の変異が見出されている。 悪性胸膜中皮腫は職業性および環境性の発ガン物質であるアスベスト暴露によって引き起こされ、その機序として活性酸素の発生によるDNA損傷が推定されている。悪性胸膜中皮腫では、p16およびNF2遺伝子の変異とともに、他の種々の悪性腫瘍と同様にp53の変異についても報告されている。すなわち、p53の変異は、20例中2例および4例中2例の細胞株で、また15例中1例および13例中0例の腫瘍組織でそれぞれ認められている。これに対して、Ha-ras癌遺伝子(以下、ras)では腫瘍組織(11例)、Ki-rasでは細胞株(20例)の解析では変異は見出されていない。 本研究では、悪性胸膜中皮腫患者19例(日本人7例、米国人12例)から得られた腫瘍組織のp53、Ha-rasおよびKi-rasの変異を同時に解析した。これらでは、米国の2症例を除きすべてアスベスト暴露が確認されている。 対象は、1)神奈川県横須賀市横須賀共済病院にて悪性胸膜中皮腫で死亡した日本人7例の剖検組識と2)米国ニューヨーク市マウントサイナイ医科大学にて病理検査を目的として集められた12例の米国人悪性胸膜中皮腫患者の開胸生検組織である。組織学的診断は共に病理専門医によって行われている。 DNA抽出は、ホルマリン固定後パラフィン包埋された薄切組織を用い、脱パラフィン処理後、フェノール・クロロフォルム法により行った。また、Normal Controlとして正常男性の末梢血の白血球DNAを同法にて抽出した。これらのDNAを、PCR装置を用い30から40サイクルの反応を行い増幅した。今回増幅した部位は、p53はExon5から9までの各Exon、またHa-rasとKi-rasでは特異的変異部位Codon12、13、61を含むExon1および2である。増幅されたDNAはさらにSSCP泳動を行うため、PCR装置を用い[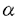 -32P]dCTPを添加して20から40サイクルの反応を繰り返した。SSCP泳動は5%および10%のグリセロールを加えた(日本人症例では5%のみ)5%アクリルアミドゲルを用い35ワットで行った。泳動後ゲルを乾燥させX線フィルムに感光させて観察した。SSCPで異常バンドが認められた症例はゲルより異常バンド部位のみを切り出しDNAを抽出後、自動シークエンサーにより塩基配列を解析した。 -32P]dCTPを添加して20から40サイクルの反応を繰り返した。SSCP泳動は5%および10%のグリセロールを加えた(日本人症例では5%のみ)5%アクリルアミドゲルを用い35ワットで行った。泳動後ゲルを乾燥させX線フィルムに感光させて観察した。SSCPで異常バンドが認められた症例はゲルより異常バンド部位のみを切り出しDNAを抽出後、自動シークエンサーにより塩基配列を解析した。 結果は以下の通りである。1)日本人患者ではp53、H-rasおよびKi-rasのいずれでもSSCPの異常バンドは検出されなかった。2)米国人患者では2例にp53のSSCPの異常バンドが認められた。しかし、H-rasおよびKi-rasでは認められなかった。これらの2例中1例ではCodon233(Exon7)にCACからCGCへの変異が認められHistidineからArginineへのアミノ酸変異であった。この症例は、一番のヘビースモカーであり、Biphasic Typeの組織型を有した。もう一例では、Codon213(Exon6)にCGAからCGGへの変化は認められたがアミノ酸変化は認められず、IARCの多型情報より多型と判断した。 アスベスト暴露と喫煙の肺癌への影響は相乗的であるとの報告がなされている。したがって、アミノ酸変異症例では、この相乗効果によりp53の変異が起こり、悪性胸膜中皮腫発症に何らかの役割を果たしている可能性が示唆される。今後、アスベスト関連悪性胸膜中皮腫のp53の遺伝子解析を行う場合には喫煙歴も考慮した更なる研究が必要であると考えられる。 p53には種を超えてアミノ酸配列が保存されている5個の保存領域が存在する。自然発生腫瘍のp53変異はこの領域に集中し、保存領域iiからvはExon5から8に存在している。既報の悪性胸膜中皮腫でのp53変異例(5例)と今回の症例を含めて6例中2例(我々の症例と他1例)にこれらの保存領域以外での変異が存在していた。したがって、我々の症例を含む2例はp53変異の役割が他の症例と異なる可能性がある。また、自然発生腫瘍ではp53の変異はCpG部位に多く認められているが、今回の変異を含めて6例中4例(先の2例を含む)が、この部位以外の変異であった。これらのこととp53変異率が低いことを考えると、悪性胸膜中皮腫と他の自然発症腫瘍との間には腫瘍形成上p53変異の果たす役割に異なる働きがあることが考えられる。 また、組織型と変異についての考察を試みたが、1例を除き先の報告の組織型を同定することができずそれにはいたらなかった。 |