維管束植物において、根で吸収した水分や塩類は道管や仮道管を通して輸送される。この道管・仮道管を形作るのが管状要素であり、この細胞は植物体内では前形成層あるいは形成層から形成されるが、植物ホルモンや傷害により、in vitroで誘導することも可能である。ヒャクニチソウ分化誘導系では、単離葉肉細胞が、器官から単離される時の傷害ストレス、培地に含まれるオーキシン、サイトカイニンの両植物ホルモンにより管状要素への分化を開始する。この分化過程において発現するTED3遺伝子は、細胞の形態的変化が見られる直前の時期に発現し(図1)、その発現の細胞特異性から、形態形成に先立つ遺伝子発現制御機構を解析するのに適した遺伝子であると考えられる。また、アンチセンスDNAにより、TED3遺伝子の発現を抑制した毛状根では伸長が抑制されることから、TED3タンパク質は成長に必要であることもわかっている(岡澤、修士論文 1997)。 これまで管状要素の形態形成に伴って発現する遺伝子、特にリグニン合成系の酵素遺伝子の発現解析はあるが、形態形成に先立って発現する遺伝子の発現解析はまったく行われてきていない。そこで私は、TED3遺伝子を用いて、管状要素分化の形態形成に先立つ遺伝子発現制御機構を解析することにした。修士過程ではTED3に相当するゲノムクローンを単離し、GUS遺伝子をマーカーとしてシロイヌナズナに導入したときの栄養器官での発現組織、細胞を調べた。本研究では更に詳細な発現解析を行うとともに、2つの新たなアッセイ系を開発しTED3プロモーターのシス領域を解析した。 (1)TED3プロモーターによる組織内発現 修士過程での解析より、栄養器官ではTED3プロモーターは管状要素あるいはその前駆細胞で強く発現することが明らかになっていたので(図2)、本研究ではまず十分な活性を持つプロモーター(-537〜+291)にGUSをつないだコンストラクトをもつ形質転換体を用いて生殖器官での発現を調べた。その結果、花弁の葉脈においては発現が認められなかったが、多数の管状要素細胞が分化、分枝してくる開花時の柱頭下部の領域でGUS染色が認められ、これは管状要素分化に関連した発現であることが示唆された(図3-1)。一方、雄蕊が伸長したものでは雄蕊に、花の終わったものでは花被片痕の部分に発生に伴う発現領域の変化が見られた。 次に、この形質転換体の芽生えの葉に物理的傷害を与え、その48時間後にGUS染色した。その結果、傷害を与えた部位周辺の葉肉細胞、表皮細胞では新たな発現は見られなかったが、傷害部位近くの維管束での発現が、傷害を与えていない葉の維管束で見られるものより強くなっていた。この結果、傷害そのものがすべての組織での発現を誘導するのではなく、維管束組織の発現をのみ強めていることが示された(図3-2)。 (2)胚軸を用いた発現解析方法の開発と管状要素での発現制御シス領域の限定 シロイヌナズナの下胚軸を切り取り、カルス化を誘導する培地上に静置すると両端にカルスが形成され、このカルス内ではほうき状に広がる形で多数の管状要素が分化する。この現象を利用して、管状要素分化を誘導したときのTED3プロモーター活性のモニターを試みた。その結果、分化条件と非分化条件での発現を比べると明らかに分化条件でGUS活性が高かった。35Sプロモーターでは分化条件と非分化条件では大きな違いはないことから、この差はTED3プロモーター特有の性質であることがわかった。(図4-1) そこでこのアッセイ方法を用いて、5’欠失クローンを導入したシロイヌナズナにおけるTED3プロモーター活性を測定した。その結果、分化条件でのみ、-237以上削ったプロモーターで顕著な活性減少が認められた(図4-2)。  図表(図1)ヒャクニチソウ葉肉細胞から管状要素細胞へと分化する過程で発現するTED遺伝子群と二次壁形成に関与する酵素遺伝子 / (図2)-537 TED3プロモーター+GUSの形質転換シロイヌナズナの栄養器官におけるGUS活性局在。A.茎頂(16日目)B.ロゼッタ素(16日目)C,D.芽生え(16日目)E.F.葉柄横断切片(22日目)G,H.芽生え(3日目)側脈がまだ形成されていない子葉(G)と形成されている子葉(H)バーはそれぞれ500 図表(図1)ヒャクニチソウ葉肉細胞から管状要素細胞へと分化する過程で発現するTED遺伝子群と二次壁形成に関与する酵素遺伝子 / (図2)-537 TED3プロモーター+GUSの形質転換シロイヌナズナの栄養器官におけるGUS活性局在。A.茎頂(16日目)B.ロゼッタ素(16日目)C,D.芽生え(16日目)E.F.葉柄横断切片(22日目)G,H.芽生え(3日目)側脈がまだ形成されていない子葉(G)と形成されている子葉(H)バーはそれぞれ500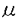 m(A,B,C),50 m(A,B,C),50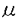 m(D,E,F),200 m(D,E,F),200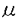 m(G,H) / (図3-1)-537 TED3プロモーター+GUSの形質転換シロイヌナズナの生殖器官(花)におけるGUS活性局在。A.雄蕊の短い花.柱頭下部にGUS活性が局在する B.雄蕊の伸長した花.雄蕊にGUS活性が局在 C.さや、花被片痕にGUS活性が局在D.柱頭下部を拡大 / (図3-2)-537 TED3プロモーター+GUSの形質転換シロイヌナズナに傷害を与えた時のGUS活性 14日目の芽生えのロゼッタ葉に針で傷害を与えた.葉はリン酸パッファー中で48時間インキュベートし、その後GUS活性の局在を観察した。 / (図4-1)シロイヌナズナ下胚軸を用いた、カルス内管状要素分化誘導実験。〓〓後14日目のシロイヌナズナ下胚軸を切り取り、2.4-Dとkinetinを含む、またはそのどちらかを単〓で含む培地に静置し、10日後のGUS活性を測定した。培地1(0.5mg/l 2.4-D)と培地2(0.5mg/l 2.4-D、0.05mg/l kinetin)に置いた下胚軸はカルス形成と未〓〓での管状要素分化が誘導される。写真はX-gloc染色したカルス未〓〓。培地3(0.05mg/l kinetin)と培地4(1.0mg/l kinetin)ではカルス化、管状要素分化ともに見られない.グラフ上は35Sプロモーター+GUS形質転換体、下は-537TED3プロモーター+GUS形質転換体。 / (図4-2)下胚軸を用いたアッセイ系によるTED3プロモーター5’欠失変異体解析。グラフ左は培地3(0.05mg/l kinetin)に静置した下胚軸のGUS活性、中は培地2(0.5mg/l 2.4-D、0.05mg/l kinetin)に静置した下胚軸のGUS活性。右のグラフは培地3に静置した下胚軸のGUS活性を1として、培地2でのGUS活性を絶対値で表わしたもの。白いバーは個々の形質転換体を示し、黒いバーはコンストラクト中の平均値を示す。(3)ヒャクニチソウ培養系を用いたトランジェントアッセイ系の開発と管状要素での発現制御シス領域の限定 m(G,H) / (図3-1)-537 TED3プロモーター+GUSの形質転換シロイヌナズナの生殖器官(花)におけるGUS活性局在。A.雄蕊の短い花.柱頭下部にGUS活性が局在する B.雄蕊の伸長した花.雄蕊にGUS活性が局在 C.さや、花被片痕にGUS活性が局在D.柱頭下部を拡大 / (図3-2)-537 TED3プロモーター+GUSの形質転換シロイヌナズナに傷害を与えた時のGUS活性 14日目の芽生えのロゼッタ葉に針で傷害を与えた.葉はリン酸パッファー中で48時間インキュベートし、その後GUS活性の局在を観察した。 / (図4-1)シロイヌナズナ下胚軸を用いた、カルス内管状要素分化誘導実験。〓〓後14日目のシロイヌナズナ下胚軸を切り取り、2.4-Dとkinetinを含む、またはそのどちらかを単〓で含む培地に静置し、10日後のGUS活性を測定した。培地1(0.5mg/l 2.4-D)と培地2(0.5mg/l 2.4-D、0.05mg/l kinetin)に置いた下胚軸はカルス形成と未〓〓での管状要素分化が誘導される。写真はX-gloc染色したカルス未〓〓。培地3(0.05mg/l kinetin)と培地4(1.0mg/l kinetin)ではカルス化、管状要素分化ともに見られない.グラフ上は35Sプロモーター+GUS形質転換体、下は-537TED3プロモーター+GUS形質転換体。 / (図4-2)下胚軸を用いたアッセイ系によるTED3プロモーター5’欠失変異体解析。グラフ左は培地3(0.05mg/l kinetin)に静置した下胚軸のGUS活性、中は培地2(0.5mg/l 2.4-D、0.05mg/l kinetin)に静置した下胚軸のGUS活性。右のグラフは培地3に静置した下胚軸のGUS活性を1として、培地2でのGUS活性を絶対値で表わしたもの。白いバーは個々の形質転換体を示し、黒いバーはコンストラクト中の平均値を示す。(3)ヒャクニチソウ培養系を用いたトランジェントアッセイ系の開発と管状要素での発現制御シス領域の限定 パーティクルガンを用いて、ヒャクニチソウ管状要素分化系でのトランジェントアッセイ系の開発を試みた。遺伝子導入方法に関しては、斎藤(修士論文、1997)の方法を用いた。遺伝子導入のタイミングは様々な条件を検討した結果、培養後36-42時間がすぐれていることが明らかになった(図5)。また、レポーター遺伝子としてはホタルルシフェラーゼを用いることで、感度の高いアッセイ系を確立できた。この系を用いて5’欠失シリーズの活性を測定したところ、下胚軸を用いたアッセイ系と同様に-237bpまで5’領域を欠失させると活性が低下した(図6)。 次に、リンカースキャンを行った。-354bpから-157bpの間を20bpずつ異なる配列に置き換えた変異プロモーターを作製して活性の変化を調べた。その結果、-257〜-237の領域を置き換えた変異プロモーターで最も活性が低下した(図7)。 TED3プロモーター中には-141〜-122領域にもH-box様の特徴的な配列が見られる。また、この配列はトウモロコシPタンパクのターゲット配列であり、beam PAL2プロモーターにおいては木部と花での発現に必要な配列である。この配列の影響を見るために、-157〜-75、-120〜-75の領域を欠失させ、ヒャクニチンウトランジェントアッセイ系で活性を測定した。その結果、-120〜-75を欠失させたものでは△354とほとんど変わらないが、-157〜〜75を欠失させたものでは活性の低下が見られた(図8-1)。このことから、この領域のH-box様配列もまた、TED3プロモーター活性に関わるシスエレメントであることが示唆された。この時同時に、非分化培地との比較を目的として、ホルモンフリー(Co)培地で培養した細胞への導入も行ったが、非分化培地では活性が非常に低く、プロモーター間の違いはほとんど見られなかった(図8)。 (4)TED3結合因子の検索 ゲルシフトアッセイにより、TED3プロモーターに結合してその発現に関与するタンパクの検索を試みた。管状要素分化系における培養42時間目のヒャクニチソウ培養細胞から核タンパクを抽出した後、TED3上流配列断片をプローブとして、ゲルシフトアッセイを行った。-354〜-75断片をプローブとしてゲルシフトアッセイを行ったところ、タンパクとの結合が検出された。この複合体は分化培地(D)だけでなく、コントロールのCN培地で培養した細胞の核タンパクを用いたものでも検出された(図9)。しかし結合の強さは分化細胞の核タンパク質で顕著であった。競合体として-492〜+291、-354〜+291、-237〜+291、157〜+291のラベルしていない断片を加えたところ、核タンパクとの結合はCN、D共に、いずれも-492〜+291、-354〜+291断片を加えたときに阻害され、-237〜+291、-157〜+291断片を競合体としたときには複合体が検出された(図10)。次に、-237〜-75断片を用いてゲルシフトアッセイを行った。その結果、-237〜-75で特異的に結合するバンドが観察された。(図10)。 以上の結果より、-354〜-237、-237〜-75の領域それぞれに結合する核タンパクの存在が考えられた。しかし、これらはCN、D培地の培養細胞共に存在するため、発現の分化特異性を付与するためには、核タンパク質の分化特異的修飾のような制御の可能性が考えられた。 まとめ 本研究においては、管状要素特異的遺伝子TED3プロモーターの発現制御の解析と、そのための実験条件の検討を行った。その結果、管状要素分化細胞という限られた細胞で発現する遺伝子のプロモーター解析として、シロイヌナズナの下胚軸を用いた誘導系によるアッセイが有効であることを示した。また、分化する過程に一過的に発現する遺伝子の解析であり、しかも対象とする分化は細胞死へと向かうために、実験を行うタイミングが重要であるトランジェントアッセイにおいては、培養開始36時間目から42時間目での遺伝子導入により、活性の測定が可能であることがわかり、これは同じ時期に発現する他の遺伝子のプロモーター解析にも応用できるものと思われる。 以上の実験系を用いて行ったTED3プロモーター解析とゲルシフトアッセイにより、次のようなモデルを想定した(図11)。TED3上流域には-354〜-120に分化特異的発現を支配する領域が存在し、特に-257〜-237と-157〜-120にシス因子が存在する。-257〜-237にはほぼパリンドローム構造をとるAT-richな配列(5’-CTTTTAAAAAG-3’)が、-157〜-120には2つのCCTACC配列が存在し、これらがシス因子である可能性が考えられた。またゲルシフトアッセイからは、-354〜-237と-237〜-75に結合する核タンパク質の存在が示され、それぞれ-257〜-237と-157〜-120に結合すると予想される。また、分化特異的な核タンパク質の修飾がTED3遺伝子の分化特異的発現に関与している可能性が考えられた。 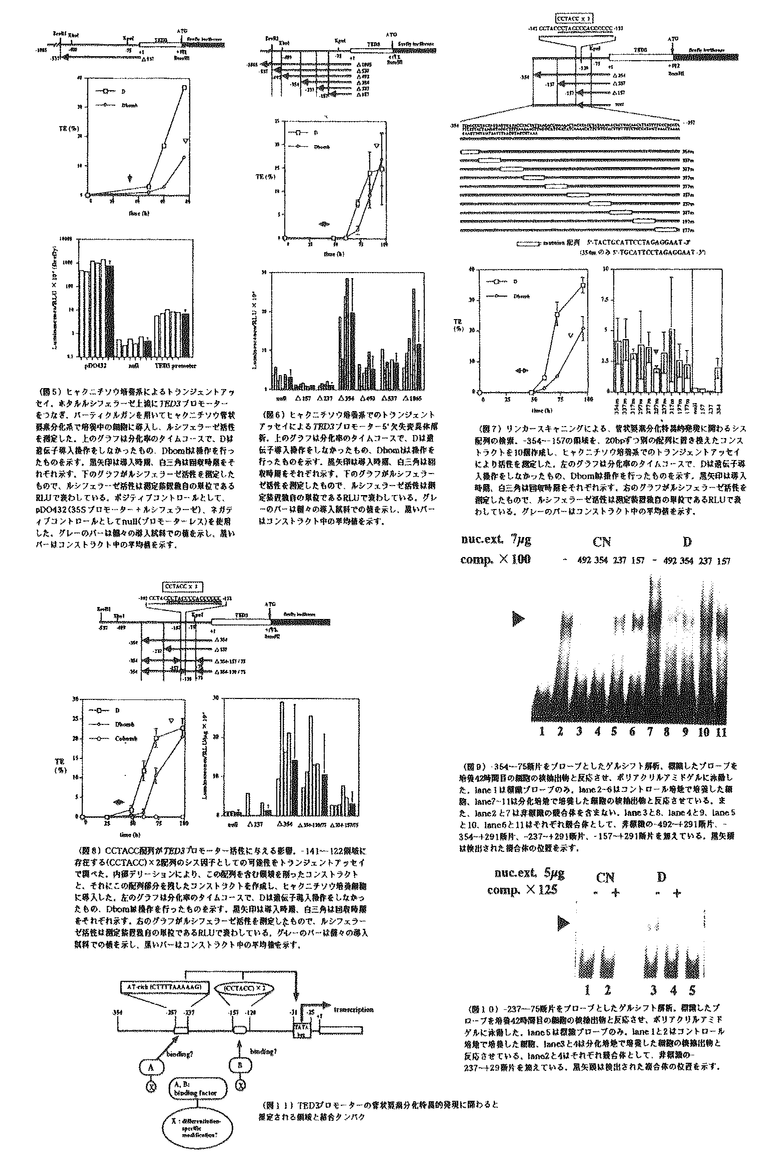 図表(図5)ヒャクニチリウ培養系によるトランジェントアッセイ.ホタルルシフェラーゼ上流にTED3プロモーターをつなぎ、バーティクルガンを用いてヒャクニチソウ管状要素分化系で培養中の細胞に導入し、ルシフェラーゼ活性を測定した.上のグラフは分化率のタイムコースで、Dは遺伝子導入操作をしなかったもの、Dbombは操作を行ったものを示す.黒矢印は導入時期、白三角は回收時間をそれぞれ示す.下のグラフがルシフェラーゼ活性を測定したもので、ルシフェラーゼ活性は測定装置独自の単位であるRLUで表わしている.ポジティブコントロールとして、pDO432(35Sプロモーター+ルシフェラーゼ)、ネガティプコントロールとしてnull(プロモーターレス)を使用した.グレーのバーは個々の導入試料での値を示し、黒いバーはコンストラクト中の平均値を示す. / (図6)ヒャクニチソウ培養系でのトランジェントアッセイによるTED3プロモーター5’欠失変異体解析.上のグラフは分化率のタイムコースで、Dは遺伝子導入操作をしなかったもの、Dbombは操作を行ったものを示す.黒矢印は導入時間、白三角は回收時間をそれぞれ示す.下のグラフがルシフェラーゼ活性を測定したもので、ルシフェラーゼ活性は測定装置独自の単位であるRLUで表わしている.グレーのバーは個々の導入試料での値を示し、黒いバーはコンストラクトの平均値を示す. / (図7)リンカースキャニングによる、管状要素分化特異的発現に関わるシス配列の検案.-354〜-157の領域を、20bpずつ別の配列に置さ換えたコンストラクトを10個作成し、ヒャクニチソウ培養系でのトランジェントアッセイにより活性を測定した.左のグラフは分化率のタイムコースで.Dは遺伝子導入操作をしなかったもの、Dbombは操作を行ったものを示す.黒矢印は導入時期、白三角は回収時期をそれぞれ示す.右のグラフがルシフェラーゼ活性を測定したもので、ルシフェラーゼ活性は測定装置独自の単位であるRLUで表わしている.グレーのバーはコンストラクト中の平均値を示す. / (図8)CCTACC配列がTED3プロモーター活性に与える影響.-141〜-122領域に存在する(CCTACC)×2配列のシス因子としての可能性をトランジェントアッセイで調べた.内部デリーションにより、この配列を含む領域を削ったコンストラクトと、それにこの配列部分を残したコンストラクトを作成し、ヒャクニチソウ培養細胞に導入した.左のグラフは分化率のタイムコースで、Dは遺伝子導入操作をしなかったもの、Dbombは操作を行ったものを示す.黒矢印は導入時期、白三角は回収時期をそれぞれ示す.右のグラフがルシフェラーゼ活性を測定したもので、ルシフェラーゼ活性は測定装置独自の単位であるRLUで表わしている.グレーのバーは個々の導入試料での値を示し、黒いバーはコンストラクト中の平均値を示す. / (図9)-354〜-75断片をプローブとしたグルシフト解析.標識したプローブを培養42時間目の細胞の被抽出物と反応させ、ポリアクリルアミドゲルに泳動した.lane 1は標識プローブのみ.lane2〜6はコントロール培地で培養した細胞、lane7-11は分化培地で培養した細胞の被抽出物と反応させている.また、lane2と7は非標識の競合体を含まない.lane3と8、lane4と9、lane5と10、lane6と11はそれぞれ競合体として、非標識の-492〜+291断片、-354〜+291断片、-237〜+291断片、-157〜+291断片を加えている.黒矢頭は検出された複合体の位置を示す. / (図10)-237〜-75断片をプローブとしたゲルシフト解析.標識したプローブを培養42時間目の細胞の被抽出物と反応させ、ボリアクリルアミドゲルに泳働した.lane5は標識プローブのみ.lane1と2はコントロール培地で培養した細胞、lane3と4は分化培地で培養した細胞の被抽出物と反応させている.lane2と4はそれぞれ競合体として、非標識の-237-+29断片を加えている.黒矢頭は検出された複合体の位置を示す. / (図11)TED3プロモーターの管状要素分化特異的発現に関わると推定される領域と結合タンパク 図表(図5)ヒャクニチリウ培養系によるトランジェントアッセイ.ホタルルシフェラーゼ上流にTED3プロモーターをつなぎ、バーティクルガンを用いてヒャクニチソウ管状要素分化系で培養中の細胞に導入し、ルシフェラーゼ活性を測定した.上のグラフは分化率のタイムコースで、Dは遺伝子導入操作をしなかったもの、Dbombは操作を行ったものを示す.黒矢印は導入時期、白三角は回收時間をそれぞれ示す.下のグラフがルシフェラーゼ活性を測定したもので、ルシフェラーゼ活性は測定装置独自の単位であるRLUで表わしている.ポジティブコントロールとして、pDO432(35Sプロモーター+ルシフェラーゼ)、ネガティプコントロールとしてnull(プロモーターレス)を使用した.グレーのバーは個々の導入試料での値を示し、黒いバーはコンストラクト中の平均値を示す. / (図6)ヒャクニチソウ培養系でのトランジェントアッセイによるTED3プロモーター5’欠失変異体解析.上のグラフは分化率のタイムコースで、Dは遺伝子導入操作をしなかったもの、Dbombは操作を行ったものを示す.黒矢印は導入時間、白三角は回收時間をそれぞれ示す.下のグラフがルシフェラーゼ活性を測定したもので、ルシフェラーゼ活性は測定装置独自の単位であるRLUで表わしている.グレーのバーは個々の導入試料での値を示し、黒いバーはコンストラクトの平均値を示す. / (図7)リンカースキャニングによる、管状要素分化特異的発現に関わるシス配列の検案.-354〜-157の領域を、20bpずつ別の配列に置さ換えたコンストラクトを10個作成し、ヒャクニチソウ培養系でのトランジェントアッセイにより活性を測定した.左のグラフは分化率のタイムコースで.Dは遺伝子導入操作をしなかったもの、Dbombは操作を行ったものを示す.黒矢印は導入時期、白三角は回収時期をそれぞれ示す.右のグラフがルシフェラーゼ活性を測定したもので、ルシフェラーゼ活性は測定装置独自の単位であるRLUで表わしている.グレーのバーはコンストラクト中の平均値を示す. / (図8)CCTACC配列がTED3プロモーター活性に与える影響.-141〜-122領域に存在する(CCTACC)×2配列のシス因子としての可能性をトランジェントアッセイで調べた.内部デリーションにより、この配列を含む領域を削ったコンストラクトと、それにこの配列部分を残したコンストラクトを作成し、ヒャクニチソウ培養細胞に導入した.左のグラフは分化率のタイムコースで、Dは遺伝子導入操作をしなかったもの、Dbombは操作を行ったものを示す.黒矢印は導入時期、白三角は回収時期をそれぞれ示す.右のグラフがルシフェラーゼ活性を測定したもので、ルシフェラーゼ活性は測定装置独自の単位であるRLUで表わしている.グレーのバーは個々の導入試料での値を示し、黒いバーはコンストラクト中の平均値を示す. / (図9)-354〜-75断片をプローブとしたグルシフト解析.標識したプローブを培養42時間目の細胞の被抽出物と反応させ、ポリアクリルアミドゲルに泳動した.lane 1は標識プローブのみ.lane2〜6はコントロール培地で培養した細胞、lane7-11は分化培地で培養した細胞の被抽出物と反応させている.また、lane2と7は非標識の競合体を含まない.lane3と8、lane4と9、lane5と10、lane6と11はそれぞれ競合体として、非標識の-492〜+291断片、-354〜+291断片、-237〜+291断片、-157〜+291断片を加えている.黒矢頭は検出された複合体の位置を示す. / (図10)-237〜-75断片をプローブとしたゲルシフト解析.標識したプローブを培養42時間目の細胞の被抽出物と反応させ、ボリアクリルアミドゲルに泳働した.lane5は標識プローブのみ.lane1と2はコントロール培地で培養した細胞、lane3と4は分化培地で培養した細胞の被抽出物と反応させている.lane2と4はそれぞれ競合体として、非標識の-237-+29断片を加えている.黒矢頭は検出された複合体の位置を示す. / (図11)TED3プロモーターの管状要素分化特異的発現に関わると推定される領域と結合タンパク |