| 内容要旨 | | DNAが通常2重螺旋であることはよく知られていることであるが、1957年Felsenfeldらは、poly Uとpoly Aを2:1の比で混合すると、DNAが選択的に三重鎖を形成することを発見した1)。その後1980年代になって、プラスミドにおいて分子間及び分子内の2種類の三重鎖DNA構造形成が示唆され、この発見により、三重鎖DNAの研究が再び活性化された。さらに、プラスミドだけでなく、比較的短いTriplex-Forming-Oligonucleotide(TFO)がDNA塩基配列を認識することによって、antigene agentsになりうることから、急速に注目が集まり、現在も様々な研究が進められている。 3重螺旋には、third strandが二重鎖のpurine塩基に対しparallelに結合しているものと、antiparallelに結合しているものとの2typeが存在する。前者は面third strandがpyrimidine塩基であり、T・AT、 C+・GC(C+=プロトネーションされたcytosine)という配列をとる。一方、後者はthird strandがpurine塩基、もしくはthymineであり、G・GC、A・AT、T・ATという塩基対を形成する。Third strandはparallel、antiparallelどちらの場合も、DNA二重螺旋の塩基とmajor grooveで水素結合を形成する(・は、third strandとpurine塩基との水素結合を表す)。 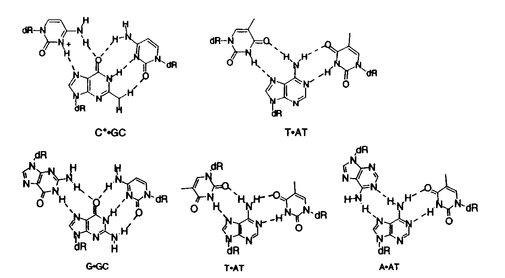 しかし、三重螺旋の実用化には未だ様々な問題点が残されている。特に問題となり、本博士論文で克服しようと試みているのが、二重鎖の一方がhomopurine(当然もう一方はhomopyrimidine)配列でなければ三重螺旋を形成しない点である。上図をみてわかるように、3つ目の塩基と二本以上の水素結合を安定に形成できるのはpurine塩基のみである。つまり、三重螺旋を形成しうるのはhomopurine配列だけであり、任意の配列に対して三重螺旋を形成できない、ということである。遺伝子の制御領域などにhomopurine homopyrimidine配列が位置していることもあるが、必ずしも都合の良いところにこのような配列が存在する訳ではない。三重螺旋を医学の分野で使用するためには、この部分を克服しなければならないと考えられている。これについては、現在も様々な研究が行われているが、未だ任意の配列に対して三重螺旋を形成させることはできていない。そこで、我々は、homopurine配列以外の任意の塩基配列を認識できるような新規修飾塩基のデザイン・合成に着手した。 認識の概念図をFigure1に、新規修飾塩基のデザインをFigure2に示した。Third strandに組み込まれた修飾塩基はX、Yの2つの部分から構成され(Figure2において、リン酸エステルでオリゴマーと結合しているguanine部分をX、adenineを認識するuracil部分をYとした)、すぐそばのthymineではなく、ひとつ向こう側のadenineを認識し、水素結合を形成する。この方法により、homopurine以外の配列でも認識させることができると考えた。 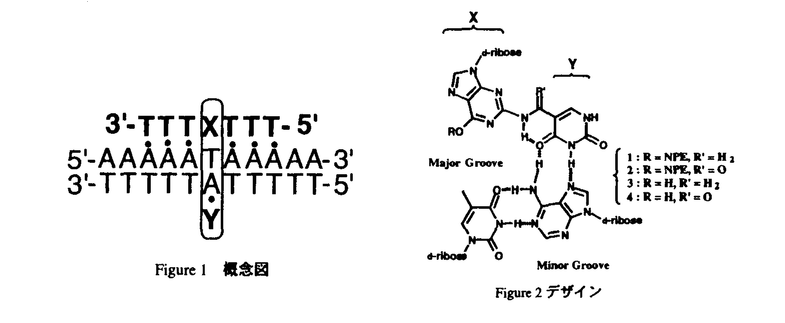 図表Figure1 概念図 / Figure2 デザイン 図表Figure1 概念図 / Figure2 デザイン 実際の合成は、2’-deoxyguanosineを原料とし、数ステップを経て以下の1〜4の修飾塩基4種類を全てを合成することに成功した(Scheme1,Scheme2)。  Scheme1a)Ac2O,Et3N,DMAP,CH3CN,rt.,quant.,b)p-nitrophenylethanol,DEAD,PPh3,dioxan,rt,.quant.,c)PVPHF,tert-butyl nitrite,toluene,85%,d)6-aminomethyl-uracil hydrochlorate,N,N diisopropylethyl-amine,DMF,80℃,35%,e)NH3,MeOH,rt.,quant.,f)DBU,CH3CN,rt.75% Scheme1a)Ac2O,Et3N,DMAP,CH3CN,rt.,quant.,b)p-nitrophenylethanol,DEAD,PPh3,dioxan,rt,.quant.,c)PVPHF,tert-butyl nitrite,toluene,85%,d)6-aminomethyl-uracil hydrochlorate,N,N diisopropylethyl-amine,DMF,80℃,35%,e)NH3,MeOH,rt.,quant.,f)DBU,CH3CN,rt.75% Scheme2a)Ac2O,Et3N,DMAP,CH3CN,rt.,quant.,b)p-nitrophenylethanol,DEAD,PPh3,dioxan,rt.,quant.,c)2,4-dihydroxypyrimidine-5-carboxylic acid,DCC,LiCl,THF,rt.,42%,d)NH2,MeOH,rt.,quant.e)DBU,CH3CN,rt.80% Scheme2a)Ac2O,Et3N,DMAP,CH3CN,rt.,quant.,b)p-nitrophenylethanol,DEAD,PPh3,dioxan,rt.,quant.,c)2,4-dihydroxypyrimidine-5-carboxylic acid,DCC,LiCl,THF,rt.,42%,d)NH2,MeOH,rt.,quant.e)DBU,CH3CN,rt.80% 2’-deoxyguanosineの水酸基をacetylで保護し、O6位をp-nitrophenylethyl ether5とした。その後、PVPHFを用いてアミノ基をフッ素化し、別途合成した6-aminomethyuracil hydrochlorateとカップリング反応を行い、6を得た。6を二種類の方法で脱保護し、それぞれ修飾塩基1及び3を得ることができた。 Scheme1と同様な方法で合成した5と2,4-dihydroxypyrimidine-5-carboxylic acidとを縮合させることで、7を得、二種類の脱保護法を用いて2、及び、4を合成することができた。O6位のp-nitrophenylethyl基(NPE)はよく保護基として用いられているものであるが、今回はUV照射によるDNAを切断するための官能基として扱い、脱保護ぜずにオリゴマーに組み込むこととした2)。三重螺旋を形成した後UV照射することで、配列選択的にDNAを切断させることができると考えている。 また、修飾塩基1、3は、実際に認識部位となるuracil部分と、リン酸バックボーンに組み込まれるguanosine部分とを、アミノメチル基で結合させている。一方、修飾塩基2、4は、アミド結合を介して結合させている。アミノメチルを介して結合させた場合、その結合はより柔軟性を持ち、アミド結合を介して結合させた場合、その結合はより堅く、分子全体がより平面に近くなると考えられる。ある程度の平面性がなければDNA塩基対のとのスタッキングが不可能になり三本鎖が不安定になるが、平面性が高すぎると水素結合を介してのHoogsteen型結合ではなく、塩基対の間にインターカレーションをした構造の方が安定化してしまうと考えられる。故に、その評価のために、アミノメチル基を用いた場合と、アミドを用いた場合の、これらの両者の差を見ることは非常に興味深いと考えられた。また、実際に合成した結果、結合の様式によって、化合物の性質が非常に異なることが判明した。 次に、合成した修飾塩基がadenineと水素結合を形成する能力があるかどうか1H-NMRで確認した。水素結合を形成したプロトン、及びその近傍のプロトンは、水素結合を形成していない時に比べ、低磁場シフトすることが知られている。比較対象はthymidineとし、thymidineと同様な水素結合形成能を持つかどうかを判断の指標とした。方法として、adenosineのCDCl3溶液に、thymidine、合成した修飾塩基をそれぞれ少量ずつ滴下し、adenosineのプロトンの低磁場シフトを観察する方法を採用した。その結果、合成した修飾塩基はthymidineと同様な水素結合形成能を持つことが確認され、特に、guanine部分と認識部位であるuracil部位をアミド結合で結合させた化合物2においては、より大きなプロトンの低磁場シフトが確認された3)。また、thymidineを加えたときに比較し、修飾塩基はH-2だけでなく、H-8のプロトンもシフトさせることが確認された。このことは、thymidineに比べ,今回合成した修飾塩基が若干ではあるが、Hoogsteen型の水素結合を形成しやすいことを示していると考えている。 次に、合成した修飾塩基をDNAオリゴマーへ組み込む実験を行った。液相合成、及び、固相合成の2種類の方法を用いて検討した結果、固相合成によって、オリゴマーの3’位に修飾塩基1と2をそれぞれ組み込むことに成功した。合成したオリゴマーは3’-XTTTTT-5’(Xは修飾塩基1または2)という配列の6merである。液相合成においても、現在3’-XTTTTT-5’の5merまで合成できている。固相合成によって合成した修飾塩基を含むオリゴマーをHPLCにて分析し、二度のHPLCによる精製を経て、目的のピークを分離することができた。現在は、それらの修飾塩基を含むオリゴマーの構造を、NMRスペクトルやMSスペクトルによって確認を行っているところである。また、修飾塩基3と4の組み込みについては、1と2を組み込んだオリゴマーをDBUで処理することで、オリゴマーを切断することなくO6位のp-nitrophenylethyl基を脱離させることができると考えている。これによって、修飾塩基3及び4を含むオリゴマーを得ることが可能と考えており、現在実際にDBUで処理したオリゴマーを分析、精製中である。また、オリゴマーの5’位、及び内部に組み込む検討も同時に進行中である。 [1]Felsenfeld,G.;Davis,D.R.;Rich A.J.Am.Chem.Soc.,1957,79,2023-2024. [2]Kuroda,R.et.al,Nucleic Acids Res.,1995,23,1524-1530. [3]Saito,A.;Kuroda,R.Tetrahedron Lett.,1999,40,4837-4840. |
| 審査要旨 | | DNAが通常2重螺旋であることはよく知られていることであるが、1957年Felsenfeldらは、DNAは二重螺旋だけではなく、三重鎖をも形成することを発見した。その後1980年代になって、プラスミドにおいて分子間及び分子内の2種類の三重鎖DNA構造形成が示唆され、この発見により、三重鎖DNAの研究が再び活性化された。さらに、プラスミドだけでなく、比較的短いTriplex-Forming-Oligonucleotide(TFO)がDNA塩基配列を認識することによって、antigene agentsになりうることから、急速に注目が集まり、現在も様々な研究が進められている。 しかし、三重螺旋の実用化には未だ様々な問題点が残されている。特に問題とされているのが、homopurine・homopyrimidine配列でなければ三重螺旋を形成しない点である。様々な研究が行われているにも関わらず、未だ任意の配列に対して三重螺旋を形成できない。遺伝子の制御領域などにhomopurine・homopyrimidine配列が位置していることもあるが、必ずしも都合の良いところにこのような配列が存在する訳ではない。三重螺旋を医学の分野で使用するためには、この部分を克服しなければならないと考えられている。これについては、現在も様々な研究が行われているが、未だ任意の配列に対して三重螺旋を形成させることはできていない。そこで、本博士論文研究では、homopurine・homopyrimidine配列以外の任意の塩基配列を認識できるような新規修飾塩基のデザイン・合成を行い、オリゴマーへの組み込み、三重螺旋形成の予備実験を行った。 本博士論文では、第一章序論において、三重螺旋の構造や実用化への問題点がを記され、第二章本論では実際に行ったデザイン及び合成について書かれている。まず<本論1.>として、三重螺旋形成に向けた研究や様々な修飾塩基について触れ、それらをふまえた新規修飾塩基のデザインを行っている。それらの修飾塩基はhomopurine・homopyrimidine配列以外の任意の塩基配列を認識することをを目指したものであり、TA pairを認識可能な4種類の新規修飾塩基をデザインしている。4種類の修飾塩基は、リン酸バックポーンに組み込まれるguanosine部位と、向かい側のadenineを認識するuracil部位の2つの部分からなり、その2つの部位の結合様式を変えることで、修飾塩基の平面性に変化を与え、その平面性の差によるDNAとの相互作用の差を観察しようとした。 <本論2.>ではモノマーの合成実験について書かれており、保護基の選択、反応条件の確立など、細かい部分まで触れられている。実際の合成は、2’-deoxyguanosineを原料とし、数ステップを経て、デザインした4種類の修飾塩基、それぞれを合成することに成功し、種々の機器分析により、目的の化合物であることが確認された。核酸の合成は有機合成の中でも特殊な分野であり、この修飾塩基の合成には非常に困難を伴った。特に2つの部位の結合生成反応の検討に多くの時間を要した。しかし、未だ大量合成には成功しておらず、今後の課題とされる。 <本論3.>では、合成した修飾塩基がadenineと水素結合を形成する能力があるかどうか1H-NMRで確認している。水素結合を形成したプロトン、及びその近傍のプロトンは、水素結合を形成していない時に比べ、低磁場シフトすることが知られている。比較対象はthymidineとし、thymidineと同様な水素結合形成能を持つかどうかを判断の指標とした。方法として、adenosineのCDCl3,溶液に、thymidine、合成した修飾塩基をそれぞれ少量ずつ滴下し、adenosineのプロトンの低磁場シフトを観察する方法を採用した。その結果、合成した修飾塩基はthymidineと同様な水素結合形成能を持つことが確認された。また、対照化合物との比較により、水素結合に関与しているのはuracil部位であることが確認された。 <本論4.>では、合成した修飾塩基をDNAオリゴマーへ組み込む実験について書かれている。ホスホロアミダイト法を用いて、液相合成法、及び、固相合成法の2通りの方法を用いてオリゴマーへの組み込みを行った。その結果、固相合成法によって、3’位に修飾塩基を組み込んだ6merのオリゴマーを2種類の修飾塩基について、また、5’位に修飾塩基を組み込んだ6merのオリゴマーを1種類の修飾塩基について、それぞれ合成することに成功した。液相合成においても、3’位に修飾塩基を組み込んだ6merのオリゴマーを、1種類の修飾塩基について合成する事ができた。 <本論5.>では、合成した修飾塩基を含むオリゴマーと、20merの二本鎖DNAを用いて行った、三本鎖DNA形成実験について書かれている。現在進行中の実験であるため、確実な結果とはいえないが、三本鎖を形成したと考えられる結果が得られた。しかし、さらに電気泳動の条件やその他の条件(塩濃度依存性等)の検討が必要と考えられる。また、20merの二本鎖DNAに組み込んである制限酵素認識部位、メチル化酵素認識部位などを利用した、三本鎖形成の確認も行う予定である。 前述したように、任意の配列について三重螺旋を形成させた例はない。この修飾塩基によってそれが可能となれば,医学的にも広く応用を考えることができ、三重螺旋形成の研究においても大きな進歩となる。また、多少でも塩基選択性が得られたならば、修飾塩基をさらに開発していくことで、さらに最適化していくことができ、今後の三重螺旋の応用に向けての大きな進歩となるであろう。 本博士論文研究では、この研究の中で最も困難と考えられる修飾塩基の合成スキームを確立し、さらに、オリゴマーへの組み込みを行った。また、それらを用いて、三重領形成実験も行っている。学位(学術)請求者はこれらの論文研究をすべて3年間で行い、その研究内容は学位を与えるに値すると考えられる。 |