| 内容要旨 | | DNAの相同組換えは,微生物から高等生物に至るまで広くみられる普遍的な生命現象であり,生物の遺伝的な多様性を生み出すだけでなく,致命的なDNA損傷である二重鎖切断の修復においても重要な働きをしている.大腸菌では,RecAタンパク質が相同組換えにおいて中心的役割を果たしており,相同な塩基配列を持つ単鎖DNAと二重鎖DNAとを対合させ,ヘテロ二重鎖DNAの形成をおこなうことが知るれている.RecAはATP存在下で,単鎖DNAに協同的に結合してフィラメント状の前駆体を形成した後,二重鎖DNAと結合してこれら2つのDNA鎖を対合させることがわかっているが,その反応機構には,明らかにされていない点が多い.真核生物ではRecAのホモログであるRad51タンパク質が,相同組換えにおいて機能している.Rad51は,RecAと同様な活性を持っており,またDNAに結合すると,RecAと極めてよく似たフィラメント構造をつくる.これらのことから,RecAとRad51は同一のメカニズムで組換え反応をおこなっていると考えられる. RecAはADP結合型での結晶構造から,N末端の短い配列,中央ドメイン,およびC末端ドメインからなることがわかっている.このうち,中央ドメインはRecAとRad51の間で保存されているが,Rad51ではRecAのC末端ドメインにあたる部分が存在せず,代わりにN末端側に,RecAより長い配列が存在する.RecAのN末端の短い領域は,フィラメント形成の際,自己会合に必要な部分である.また中央ドメインには.RecA-単鎖DNAフィラメント中でDNAを結合していると考えられているループ領域と,ATP結合部位が含まれている.結晶中でRecAは,らせん状のフィラメント構造をつくっているが,C末端ドメインはこのフィラメント同士のパッキング相互作用に関っていることから,溶液中においても,フィラメント間相互作用,すなわち蛋白質-蛋白質相互作用をつかさどる部位であるという仮説が提唱され,広く受入れられてきた.これに対し,変異体を用いた解析から,C末端ドメインはRecA-単鎖DNAフィラメントと二重鎖DNAとの相互作用に必要であることも示唆されている. 本研究では,まずRecAのC末端ドメインの機能を明らかにするため,C末端ドメインを単離して,NMRを用いて解析をおこなった.続いてRad51に特有なN末端の領域についても,同様に単離して構造及び機能の解析をおこなった.これら2つの解析から,RecAのC末端ドメインとRad51のN末端ドメインが,同様の機能を担っている事を示唆する結果を得た.以下にこれら実験の詳細を述べる.また,Rad51のN末端ドメインの構造解析の際,半自動化プログラムを作成したが,この手法について,RecAの相互作用因子である大腸菌DinIタンパク質の構造解析への適用例も含め,Appendixに詳細を記した。 RecAタンパク質のC末端ドメインに対応するポリペプチド,RecA(268-330)の発現系を構築し,ノンラベルおよび15Nラベルされたタンパク質を調製した.続いてこれらを用い,NMRによってRecA(268-330)の立体構造を決定した(図1左).NMRによって決定された構造は,結晶構造の対応する部分とよく似ており,NMRの平均構造と結晶構造との間の 原子についてのr.m.s.d.は,1.51Åであった.しかし,これらの構造にはGly295の近傍において大きな差異(Gly295 原子についてのr.m.s.d.は,1.51Åであった.しかし,これらの構造にはGly295の近傍において大きな差異(Gly295 では5.38Å)があることが分かった.Gly295の周辺は,結晶中でクリスタル・パッキングのインターフェイスとなっている部位であり,Lys294,Glu296,Lys297の側鎖が隣のフィラメント中の分子の側鎖と静電的な相互作用をしている.従って溶液構造と結晶構造の差異は,この事に起因すると考えられた.結晶中で見られるこのフィラメント間の相互作用が,同様に溶液中でも起こっているという前述の仮説を検証するため,RecA(268-330)に完全長のRecAを混合したが,NMRスペクトル上に変化は観測されず,直接の相互作用を示す証拠は得られなかった. では5.38Å)があることが分かった.Gly295の周辺は,結晶中でクリスタル・パッキングのインターフェイスとなっている部位であり,Lys294,Glu296,Lys297の側鎖が隣のフィラメント中の分子の側鎖と静電的な相互作用をしている.従って溶液構造と結晶構造の差異は,この事に起因すると考えられた.結晶中で見られるこのフィラメント間の相互作用が,同様に溶液中でも起こっているという前述の仮説を検証するため,RecA(268-330)に完全長のRecAを混合したが,NMRスペクトル上に変化は観測されず,直接の相互作用を示す証拠は得られなかった. 次にDNAとの相互作用について検討をおこなった.RecA(268-330)に12bpの二重鎖DNAを混合すると,Trp290,Gly301,Lys302を中心として立体構造上近接したいくつかの残基において,主鎖NHの化学シフト値がDNA濃度依存的に変化し,シグナルの線形が広幅化することが分かった(図1右).また,Ala 303は,蛋白質単体の時と比ベシグナル強度が著しく増加した.これらの変化にはDNAの塩基配列の特異性は無かったが,単鎖DNAの場合では、化学シフト変化は小さく,また化学シフト変化が飽和に達するDNAの濃度も高い事がわかった.以上の結果は,RecA(268-330)がDNAと直接相互作用しており,結合は二重鎖DNAに優先的であること,また化学シフト変化の大きい残基が集中している領域は,DNAとの結合部位となっている事を示している.  (左)NMRによって得られたRecA(268-330)の立体構造.計算の結果得られた30個の構造の主鎖N, (左)NMRによって得られたRecA(268-330)の立体構造.計算の結果得られた30個の構造の主鎖N, ,C’原子の重ね合わせを,ステレオ図で示した.(右)RecA(268-330)に,二重鎖DNA(a),単鎖DNA(b)をそれぞれ加えたときの化学シフトの変化.1H-15N HSQCスペクトルの一部の領域を示した. ,C’原子の重ね合わせを,ステレオ図で示した.(右)RecA(268-330)に,二重鎖DNA(a),単鎖DNA(b)をそれぞれ加えたときの化学シフトの変化.1H-15N HSQCスペクトルの一部の領域を示した. RecAのC末端ドメイン内のDNA結合部位は,二重鎖DNA選択的である事,DNAとの解離会合が速い事,RecAフィラメントのらせんの溝に突き出すように位置している位置的特徴から,DNAの対合反応の過程で二重鎖DNAがRecA-単鎖DNAフィラメント内に取り込まれる際,最初にDNAと相互作用する部位であると考えられる.Lys302→Asnのアミノ酸置換によって,RecAの二重鎖DNAとの相互作用が特異的に損なわれるという生化学的解析の結果は,この考えと良く符号する.また,Gly301→Aspの変異によって大腸菌のRecAに依存した組み換え能が失われることや,Trp290,Gln300,Gly301,Lys302は真正細菌のRecAホモログ間でほぼ完全に保存されていることも,これらの残基を含む領域が機能的に重要であることを裏付けている. 真核生物におけるRecAホモログであるRad51は,RecAのC末端ドメインに対応する部分を欠いており,代わりにN端側に余分な配列を持つ.従って,このN末端領域は,他のタンパク質との相互作用などといった,Rad51特異的な機能に関与している可能性がある.また,RecAのC末端ドメインの代わりとなって機能している事も考えられた.そこで次に,ヒトRad51のN端部に対応するポリペプチド,HsRad51(1-114)を作製して,解析をおこなった.15N,13C/15Nラベルされたタンパク質を調製し,NMRを用いた立体構造解析をおこなった結果,この領域は -helixのみからなる,独立したドメインを形成していることがわかった(図2).またその構造は,既知のDNA結合タンパク質と弱い類似性があった.以前に報告のあった,Rad51のN末端部とRad52,Brca2との相互作用を調べるため,HsRad52,HsBrca2(3273-3309)をそれぞれRad51(1-114)に混合したが,NMRシグナルの変化は観測されず,相互作用は検出されなかった.また,全長のHsRad51との相互作用も観察されなかったことから,N末端ドメインはRad51の自己会合には関与していないと考えられる. -helixのみからなる,独立したドメインを形成していることがわかった(図2).またその構造は,既知のDNA結合タンパク質と弱い類似性があった.以前に報告のあった,Rad51のN末端部とRad52,Brca2との相互作用を調べるため,HsRad52,HsBrca2(3273-3309)をそれぞれRad51(1-114)に混合したが,NMRシグナルの変化は観測されず,相互作用は検出されなかった.また,全長のHsRad51との相互作用も観察されなかったことから,N末端ドメインはRad51の自己会合には関与していないと考えられる. 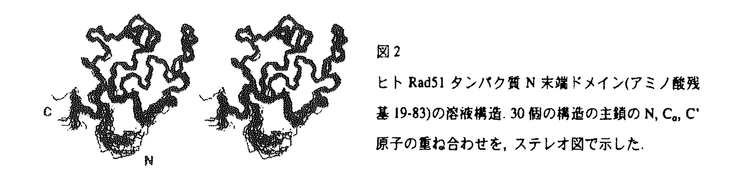 図2ヒトRad51タンパク質N末端ドメイン(アミノ酸残基19-83)の溶液構造.30個の構造の主鎖のN, 図2ヒトRad51タンパク質N末端ドメイン(アミノ酸残基19-83)の溶液構造.30個の構造の主鎖のN, ,C’原子の重ね合わせを,ステレオ図で示した. ,C’原子の重ね合わせを,ステレオ図で示した. 次に,DNAとの相互作用について検討をおこなった.HsRad51(1-114)に12bpの二重鎖DNAを混合すると,RecA(268-330)の場合と同様に,Lys64,Gly65を中心として立体構造上近接した残基において,化学シフト値の変化,シグナルの線形の広幅化がみられた.単鎖DNAの場合でも化学シフト値の変化は観察された.加えたDNAの濃度と化学シフト値の変化の関係から,二重鎖DNAとの結合はRecA(268-330)の場合と比較すると,10倍以上弱いと見積もられた.続いて,HsRad51(1-114)のDNAとの相互作用が,機能上意味のあるものであるか調べるため,変異体を用いた解析をおこなった.まずLys64をGlyに置換したHsRad51(1-114)を作製した.野生型と1H-15N HSQCスペクトルを比較したところ,変異の効果は,近傍のいくつかの残基に及んでいるが,ドメインの構造は保持されていることがわかった.そこで,全長のHsRad51にK64Gの変異を導入して,DNA結合能を調べた.ゲルシフトアッセイの結果,この変異体は単鎖DNA,二重鎖DNAのどちらに対する結合も弱くなっている事が分かり,NMRで同定された相互作用部位の重要性が確認された. 前述のように,RecAとRad51ではタンパク質フィラメントの本体となるコアドメインは共通である.従ってRad51フィラメント中でのN末端ドメインの位置を,RecAフィラメントの結晶構造中でのN末端の位置から推察すると,RecAのC末端ドメインとはらせんの溝の反対側から,やはり溝に突き出すように位置していると考えられた.電子顕微鏡による解析から,Rad51のN末端ドメインはRecAのC末端ドメイン同様に,フィラメント中でフレキシブルな状態にあることが分かっている.これらの位置的な類似性,ともに二重鎖DNAにより強く結合する性質などから,2つのドメインはともにタンパク質-単鎖DNAフィラメントと二重鎖DNAとの相互作用部位として機能していると推察される.以前に,相同組換えにおいてRecAとRad51では鎖交換反応が進行する方向が逆であるという報告があるが,2つのドメインのフィラメント中での位置が反転していることを考えると,興味深い.またRad51のN末端ドメインの場合には,単鎖DNAとの結合にも必要であることが示されたが,Rad51はN末端近くのTyr残基のリン酸化によって単鎖DNAとの結合が損なわれるという報告があり,今回わかったDNA結合部位が関与している可能性もある. |