| 内容要旨 | | 序論 イノシトールリン脂質代謝は、ホスファチジルイノシトールキナーゼ(PI kinase)、ホスファチジルイノシトールポリリン酸ホスファターゼ(IPPase)、そしてホスホリパーゼC(PLC)の三種類の酵素によって制御されている(図1、図2)。1989年にPI 3-kinaseが見つかって以来、PI-3-kinaseおよびその産物であるホスファチジルイノシトール3,4,5-三リン酸(PI3,4,5-P3)の機能を中心に、イノシトールリン脂質代謝研究が進められてきた。その結果、PI3,4,5-P3がプロテインキナーぜC(PKC)を活性化してアポトーシスを阻害することが分かるなど、細胞増殖、細胞骨格系の制御など多くの細胞機能にPI-3-kinaseが関与することは、有名なことである。加えて、この数年新規のPI 3-kinase,PI4P-5-kinase,PI5P-4-kinase、PLCなどが相次いで単離され、その活性化機構が明らかとなりつつある。さらに、ホスファチジルイノシトール-3-一リン酸がFYVEフィンガーモチーフを持つ蛋白に特異的に結合するなど、リン酸基の位置によってリン脂質自身が特異的な標的分子を持ち、特異的な機能を持つことが示されつつある。このように、イノシトールリン脂質代謝経路は、シグナル依存的にイノシトールリン脂質のリン酸化、脱リン酸化によって、多くの複雑な機能を巧みに制御する機構であり、その仕組みを解明することは大変に意義深い。 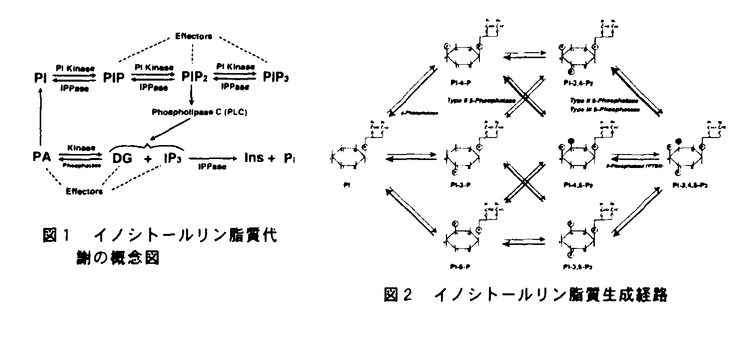 図表図1 イノシトールリン脂質代謝の概念図 / 図2 イノシトールリン脂質生成経路 図表図1 イノシトールリン脂質代謝の概念図 / 図2 イノシトールリン脂質生成経路 イノシトールポリリン酸ホスファターゼ(IPPase)は、イノシトールリン脂質の脱リン酸化酵素であり、脱リン酸化部位によって、D-1位を加水分解する1-ホスファターゼや、D-4位のリン酸基を脱リシ酸化する4-ホスファターゼなどに分類される。イノシトールポリリン酸5-ホスファターゼ(IP5Pase)は、イノシトールリン脂質やホスファチジルイノシトールのD-5位を脱リン酸化する酵素である。IP5Paseは,ホスホリパーゼC(PLC)の基質であるホスファチジルイノシトール4,5-二リン酸(PtdIns4,5-P2)を脱リン酸化を介して、プロテインキナーゼC(PKC)の活性化因子であるジアシルグリセロール(DG)や、小胞体から細胞内へのカルシウム放出を促す機能を持つ、イノシトール1,4,5-三リン酸(Ins 1,4,5-P3)の量を負に調節する機能を持つ。 これまで八種類のIP5Paseが単離されており、いずれも高度に保存された活性モチーフを持っており(図3)、基質特異性によって三種類に分類されている。Type I phosphataseは、分子量43kDaの蛋白で、Ins 1,4,5-P3および、イノシトール1,3,4,5-四リン酸 (Ins1,3,4,5-P4)のみを基質とすることから、細胞内カルシウム濃度の調節を行うと考えられている。Type III phosphataseであるSHIP(SH2 containing inositol phosphatase)はShcやBtkのSrc Homology3(SH3)ドメインと結合し、Fc受容体を介したB細胞の免疫抑制を制御する酵素である。SHIPはD-3位にリン酸基の付いている PtdIns 3,4,5-P3 およびIns1,3,4,5-P4のみを基質とすることから、PI-3-kinaseシグナルを負に制御すると考えられている。Type II phosphataseは、PtdIns 4,5-P2,PtdIns 3,4,5-P3,Ins 1,4,5-P3,Ins1,3,4,5-P4を基質とする酵素であり、複数の新規分子が最近同定されている。Synaptojaninは、N末端にIPPase活性を持つ酵母のSAC1蛋白に似たドメインを、C末端にはGrb2などのSH3ドメインと結合する、プロリンに富んだ配列を持つIP5Paseである。Synaptojanin 1は神経終末でのエンドサイトーシスの制御を行うこと、加えてプロフィリンなどのアクチン細胞骨格調節蛋白に結合するPtdIns 4,5-P2を分解し、アクチン線維を脱重合へ向かわせることも示されている。しかし、その詳しい制御機構は明らかとなっていない。.Pharbinは、最近見つかったType II IP5Paseで、膜に局在してデンドライト様の構造を誘導する機能を持つ。このように多くの分子が同定され、アクチン細胞骨格系を始め、多くの機能への関与が示唆されているものの、その生理的な意義はまだ不明な点が多い。今回、新たなIPPaseの機能を解析する目的で、新規IP5Paseの単離を行った。 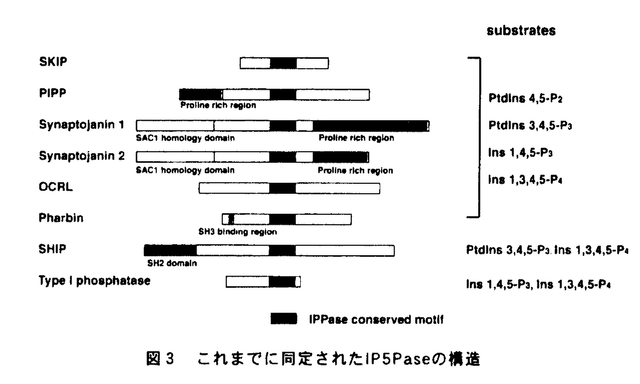 図3 これまでに同定されたIP5Paseの構造結果と考察 図3 これまでに同定されたIP5Paseの構造結果と考察 GENBANKに登録されているIP5Pase活性モチーフを持つ、およそ400bPのcDNAクローンをプローブとして、様々なcDNAライブラリーをスクリーニングした結果、2種類の新規IP5Pase様のcDNAが得られた。一つは、ラット脳ライブラリーから得られた、全長3,322bp、1001アミノ酸からなる、分子量107kDaのIP5Paseであった。このIP5Paseは、N末端にプロリンに富んだ領域を持つことから、PIPP(Prorine enriched Inositol Phosphatase)と名づけられた。PIPPは多くの蛋白活性を制御する14-3-3蛋白と結合する配列を持ち、細胞のメンブレンラッフリングを起こしている部分に局在するType IIのIP5Paseであった。もう一つは、ヒト精巣由来のライブラリーから得られた、全長約2,800bp、446アミノ酸からなる、分子量51kDaのIP5Pase様の蛋白をコードしていた。この蛋白はIP5Pase活性モチーフ以外に特徴的な配列のない単純な構造であった。ノーザンブロッテイングの結果、全ての臓器で発現が認められたが、中でも骨格筋、腎臓、心臓に非常に高い発現が見られたことから、この蛋白をSKIP(Skeletal muscle and Kidney enriched Inositol Phosphatase)と名付けた。SKIPに対する特異的な抗体を作製し、組織および細胞由来の抽出液に対してウエスタンブロッテイングを行った結果、ラットの脳や神経芽細胞であるN1E-115細胞では、予想された51kDaの蛋白の発現が見られた。一方、繊維芽細胞であるNIH-3T3細胞やSWISS-3T3細胞、筋芽細胞であるC2C12細胞では、43kDa付近に特異的な発現が認められた。この分子量の違いはスプライシングアイソフォームによるものであった。SKIPはIns 1,4,5-P3、Ins1,3,4,5-P4およびPtdIns4,5-P2(図4)に対して脱リン酸化活性を示し、イノシトール1,3,4-三リン酸(Ins 1,3,4-P3)に対する活性を示さなかったことから、SynaptojaninやPIPPと同じType IIのIP5Paseであることが示された。SKIPはPtdIns 4,5-P2に対して、他のType II IP5Paseに比べて非常に高い活性(Km=180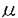 M)を示したが、Ins 1,4,5-P3に対しては6倍以上低い活性(Km=1.15mM)しか示さなかった。このことは、SKIPがPtdIns4,5-P2を特異的に脱リン酸化する酵素であることを示唆している。過剰発現させたCOS-7細胞における免疫染色の結果、SKIPは細胞質部分、中でも核周辺に集中してドット状に発現しており、その部分においてアクチンストレスファイバーの消失が見られた(図5)。また、ラット神経芽細胞であるN1E-115細胞においても、神経突起のSKIP発現部位に同様のアクチン消失が見られた。このことから、SKIPはSynaptojanin 1同様、PtdIns 4,5-P2の脱リン酸化を介してアクチン線維の構築を負に制御すると考えられる。しかし、Synaptojanin 1の様な、上皮細胞増殖因子(EGF)や血清刺激による、細胞内局在の変化は見られなかった。 M)を示したが、Ins 1,4,5-P3に対しては6倍以上低い活性(Km=1.15mM)しか示さなかった。このことは、SKIPがPtdIns4,5-P2を特異的に脱リン酸化する酵素であることを示唆している。過剰発現させたCOS-7細胞における免疫染色の結果、SKIPは細胞質部分、中でも核周辺に集中してドット状に発現しており、その部分においてアクチンストレスファイバーの消失が見られた(図5)。また、ラット神経芽細胞であるN1E-115細胞においても、神経突起のSKIP発現部位に同様のアクチン消失が見られた。このことから、SKIPはSynaptojanin 1同様、PtdIns 4,5-P2の脱リン酸化を介してアクチン線維の構築を負に制御すると考えられる。しかし、Synaptojanin 1の様な、上皮細胞増殖因子(EGF)や血清刺激による、細胞内局在の変化は見られなかった。 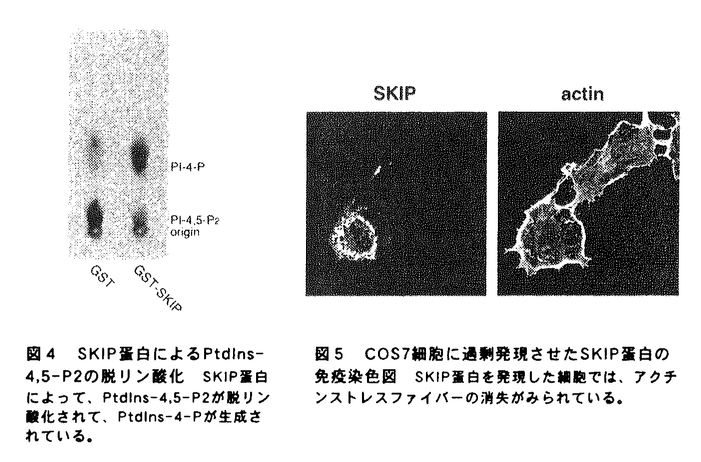 図表図4 SKIP蛋白によるPtdIns-4,5-P2の脱リン酸化 SKIP蛋白によって、PtdIns-4.5-P2が脱リン酸化されて、PtdIns-4-Pが生成されている。 / 図5 COS7細胞に過剰発現させたSKIP蛋白の免疫染色図 SKIP蛋白を発現した細胞では、アクチンストレスファイバーの消失がみられている。今後の展望 図表図4 SKIP蛋白によるPtdIns-4,5-P2の脱リン酸化 SKIP蛋白によって、PtdIns-4.5-P2が脱リン酸化されて、PtdIns-4-Pが生成されている。 / 図5 COS7細胞に過剰発現させたSKIP蛋白の免疫染色図 SKIP蛋白を発現した細胞では、アクチンストレスファイバーの消失がみられている。今後の展望 SKIPはこれまでに単離されたIP5Paseの中で、最もPtdIns 4,5-P2に対する脱リン酸化活性の強い分子であり、PtdIns 4,5-P2の機能を負に制御する分子であると考えられる。また、SKIPはSynaptojanin 1やPIPP同様、IP5Pase活性を介したアクチン細胞骨格系を制御を行う分子であると考えられる。しかし、Synaptojanin 1と違い刺激依存的な変化は確認されておらず、そのシグナル伝達機構の解明は非常に重要であると考えられる。今後は、SKIPの活性化機構および、PtdIns 4,5-P2の脱リン酸化を介するアクチン細胞骨格系制御機構の解明を目指している |
| 審査要旨 | | 本論文は2章からなり、いずれもリン脂質代謝経路においてリン脂質の脱リン酸化を行うイノシトールポリリン酸5-ホスファターゼ(以下IP5Pase)の機能解析について述べられている。ホスファチジルイノシトール4,5-2リン酸(以下PIP2)は、細胞内カルシウム濃度やプロテインキナーゼCの活性化を促すセカンドメッセンジャーとして多くの機能解析が行われている物質である。近年、PIP2が多くの蛋白と特異的に結合して細胞骨格系や細胞内物質輸送系を制御していることも明らかとなっている。IP5PaseはPIP2の脱リン酸化酵素であり、その活性を介して多くの生理機能を負に制御していることが知られている。 第1章では、新規IP5Pase遺伝子であるSKIPの単離について述べられている。まず、PIP2の細胞内濃度の制御機構を明らかにする目的で新規IP5Pase遺伝子の単離を試み、3種類の新規IP5Pase遺伝子を得ることに成功し、その結果IP5Pase分子を全部で9種類とした。次に、その内の一つ、SKIPについて機能解析を行っている。酵素学的な解析の結果、SKIPがIP3,IP4,PIP2,PIP3を全て基質とするIP5Paseであるものの、PIP2に対してIP3よりも6倍以上高い基質特異性を持つことを示している。これは、他のIP5Paseと異なりSKIPが特異的にPIP2を脱リン酸化する酵素であること意味しており、速い速度でのPIP2量の制御機構を知る上で大変注目すべき事実である。次に、培養細胞を用いた機能解析の結果より、SKIPが上皮増殖因子刺激依存的に、細胞膜に存在するPIP2の脱リン酸化を介してアクチン細胞骨格調節蛋白を細胞膜から解離させ、その結果アクチン細胞骨格を負に制御すること、さらにそれに伴って細胞膜が縮退を起こした結果、細胞が樹状突起様の形態をとるというメカニズムを提唱している。これは、PIP2によるアクチン細胞骨格系の制御機構を知る上で興味深い内容である。また、これはPIP2の減少による細胞膜の縮退と樹状突起の形成を示唆する最初の報告であり、膜構造へのPIP2の積極的な関与を提唱した点で非常に意義深いと言える。さらに、SKIPが全ての組織、細胞で発現していることを示し、PIP2やPIP3の脱リン酸化を介してPLCやPI3-キナーゼによる細胞増殖や形質転換へ向かわせる細胞内情報を終結させる可能性を挙げている。SKIPの機能に関する多くの可能性は、リン脂質代謝全体の制御機構の解明における重要性の表れであり、今後のSKIPの機能解析の意味は大変に大きいと認められる。細胞内情報伝達経路の解析およびリン脂質代謝による細胞形態変化の分子機構の解析など未だ途中点も見られるが、多くの生理機能に対して調節作用を持つPIP2を特異的に脱リン酸化するSKIPの単離は大変に意義深く、学位論文としてふさわしい内容であると認められる。 第2章では、SKIPと同じくIP5Paseであり、神経細胞に豊富に存在しエンドサイトーシスへの関与が示唆されている、シナプトジャニンのトランスジェニックマウスの作製および神経細胞における機能解析について述べられている。最初に、シナプトジャニンが記憶障害や行動異常などの症状を伴うダウン症の原因となる21番染色体に位置することを示しているが、これはリン脂質代謝が疾患に関与する可能性を提唱したもので非常に興味深い事実である。また、ダウン症原因遺伝子の同定という点からも新しい事実である。トランスジェニックマウス作製は現在までに系の確立が完了し、外形的異常を伴わないことが示されているが、今後の更なる組織学的および生理学的解析の結果が期待される。次に、培養細胞系を用いたシナプトジャニンの機能解析を行い、神経細胞の構造に影響を与えないものの、その脱リン酸化活性を介してエンドサイトーシスを抑制することを示した。いずれも現在進行中の研究であるが、リン脂質代謝酵素を用いた神経伝達制御および高次機能の解析はこれまで例が少なく、独創的な研究であると認められる。また、その結果はリン脂質代謝機構の解明に大きく寄与するものと期待できる。 以上の研究は、IP5Paseの機能解析において分子レベルから個体レベルに至るまで総合的かつ独創的であり、非常に意義深い内容であると認められる。 なお、本論文第1章は、東京大学医科学研究所の望月康弘氏、深見希代子氏、竹縄忠臣氏、東京大学医学部の浅野知一郎氏、朝日生命成人病研究所の船木真理氏との共同研究であるが、伊集院氏がほぼ全ての実験を行ったものである。そのため、本論文への伊集院氏の寄与が十分であると認められる。 したがって、博士(理学)の学位を授与できると認める。 |