翻訳伸長過程ではセンスコドンは対応したアミノアシルtRNAによって解読され、ペプチド鎖の伸長が起こる。一方、翻訳終結過程では終止コドンはtRNAではなくペプチド鎖解離因子(polypeptide release factor,RF)によって解読され、ペプチド鎖が解離する(Fig.1)。バクテリアにはコドン特異性の異なる2つのRF(RF-1はUAG/UAAに、RF-2はUGA/UAAに対応)が存在し、生育に必須なタンパク質である。  Fig.1 翻訳伸長反応と翻訳終結反応におけるコドン認識・識別機構の比較 Fig.1 翻訳伸長反応と翻訳終結反応におけるコドン認識・識別機構の比較 我々は、RFとtRNAの機能的・構造的類似から「ペプチド鎖解離因子-tRNA擬態仮説」を提唱したが(1)、RFによる直接的なコドン認識の実証も含めて30年間程RFの作用機構については決定的な解析を欠いていた。そこで、翻訳終結におけるRFの反応の素過程を解明していく上でも要になるコドン識別に関わる領域を検索することを試みた。 様々な生物由来のRFのアミノ酸配列比較から我々が提唱した、7ドメイン(A〜G)の中で、ドメインCからEには非常によく保存されたモチーフが存在する(1)。中でもドメインDには他のドメインで見られるRF-1、RF-2両グループに共通して保存されたアミノ酸残基に加えて、RF-1もしくはRF-2グループ特異的なアミノ酸残基が存在する。これらのグループ特異的なアミノ酸は、RF-1とRF-2のコドン特異性が異なることから、コドン識別を担う領域、すなわち「ペプチドアンチコドン」 と予測され、実験的に実証された(4)(後述Fig.3A参照)。 翻訳伸長反応ではtRNAのアンチコドンの正確なコドン識別のために、tRNAのリボソーム結合やtRNAの構造変化に関わるtRNAの他の領域、EF-Tu、リボソームなどの必要性が報告されている。翻訳終結反応においても、ペプチドアンチコドンが正確に機能するための領域が存在すると考えられる。このような領域の手がかりを得るために、正確なコドン識別の欠損により大腸菌内での発現誘導によって致死性を示すペプチドアンチコドン変異体を用いて復帰変異体を単離したところ、隣接するドメインCのグルタミン酸がリジンで置換された変異体が複数得られた(3)。ドメインCに特徴的に見られるグルタミン酸残基の負の電荷が逆転する変異が局在して得られ、相互作用に関わることが示唆されたので、ドメインCを正確なコドン識別に必要な領域の有力候補として考えた。 そこで、ドメインCの電荷と機能の関係を系統的に解析するために、これらのグルタミン酸に着目し、それぞれ正の電荷を持つリジンに置換した変異RF-2を作成した。RF欠損株を用いたin vivoの活性観察結果から、グルタミン酸のリジン置換(E→Kと表記)変異RF-2はどれもUGA、UAAを解読するRF-2活性はそのまま保持しており、興味深いことにいくつかのE→K変異RF-2は、元来のRF-2活性に加えてUAGを解読するRF-1活性を示した。また、リジンと同じ正の電荷を持つアルギニンで置換したE→R変異RF-2を作成し、同様に解析したところE→K変異RF-2と同種の表現型を示した。さらにE→K変異は組合わせることによりUAG解読活性がより強く表れるようになり、ドメインCのE→K変異は相加的な効果を持つことがわかった。これらのことより、UGA、UAAの解読活性とUAGの解読活性を同時に保持することから、電荷の逆転とその強度により、RF-2のコドン識別能が低下することが明らかになった。 ドメインCのE→K変異RF-2の翻訳終結能が終止コドンのみならずセンスコドンにも拡張しうることを検証するため、リボソーム、ミニmRNA、ラベルされたフォルミルメチオニンtRNAの複合体にRFを加えてフォルミルメチオニンの遊離を測定するin vitroの解離活性測定系を用いて、様々なE→K変異RF-2の様々なコドンに対する活性を測定した。in vivoの結果同様、どのE→K変異RF-2もコグネートコドンであるUGAとUAAに対する解離活性に加え、UAGやUCAなどのノンコグネートコドンに対する活性も見られた(Fig.2A)。ここでE→K変異RF-2によってコグネートコドンに対する活性が異なることから、コドン特異性を評価するために新たにRS(Relative Specificity)値を導入した。  どのノンコグネートコドンに対してもE→K変異RF-2は野生型と比較してコドン特異性が著しく低下していることが示された(Fig.2B)。 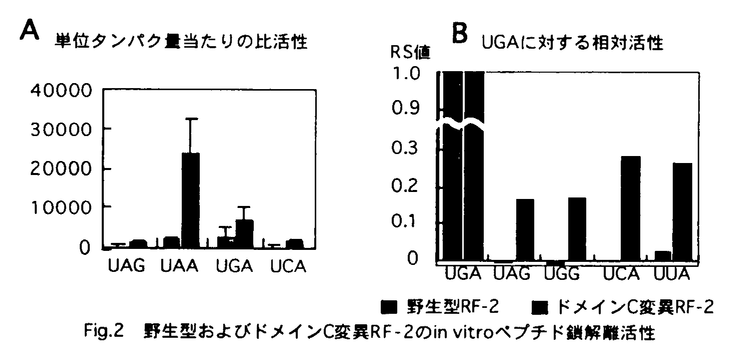 Fig.2 野生型およびドメインC変異RF-2のin vitroペプチド鎖解離活性 Fig.2 野生型およびドメインC変異RF-2のin vitroペプチド鎖解離活性 一方RF-1についても、対応するドメインCのE→K変異体を作成し、in vitroの解離活性測定を行った。E→K変異RF-1のノンコグネートコドンであるUGAに対するRS値は予想通り上昇したことから、ドメインCはRF-1、RF-2に共通した機能を有しており、正確なコドン識別のために作用していることが確認された。 E→K変異RFのセンスコドンでの翻訳終結の可能性をin vivoに近い条件で検証するため、in vitro S30翻訳系にこれらのRFを加えて解析した。レボーター遺伝子はGSTにProteinAのIgG結合領域(A’ドメイン)の3回繰り返しを結合したもので、A’ドメインの2個目と3個目の間に目的のコドンを挿入できるようになっており、目的のコドンで翻訳終結した産物(GST-2A’)とそのコドンを読み飛ばした産物(GST-3A’)をSDS-PAGEで分離し測定した。解析の結果、解離活性測定でE→K変異RF-2による顕著な解離が見られたUCAコドンにおいて、野生型と比較してE→K変異RF-2による翻訳終結が有為に確認できた。 伸長反応では三文字目のみが異なる複数のコドンを一つのtRNAで識別することがあり、一文字目、二文字目の厳格な識別に対して、三文字目はwobblingを用いた曖昧性を含んだ識別であることが多い。RF-1では三文字目が、RF-2では二文字目がAとGの二種類を許容しており、tRNAとの性質の比較は興味深い。そこでE→K変異を用いてRFにおける識別の厳密性の偏りを検証した。ニドン一文字目、二文字目、三文字目それぞれに対する効果を見るために、ノンコグネートコドンCAA、UCA、UACを用いてコグネートコドンUAAに対するE→K変異RF-1とE→K変異RF-2の解離活性を測定した。E→K変異RF-1は一文字目より二文字目、さらに三文字目のRS値の上昇が見られたが、一方E→K変異RF-2は三文字目よりも二文字目のRS値の方が高く、一文字目のRS値もE→K変異RF-1と比較すると上昇が見られた。RS値が上昇しやすいことはもともとのコドン識別において曖昧性が高いことを示していると考えられる。よって、RF-1、RF-2共にAとGの二種類を認識しなければならない位置に関しては曖昧性を含む識別であるのに対し、それ以外の位置に関してはtRNA同様、厳格な識別が行われていることが明らかになった。 これらの事実を説明するために、ドメインCは電荷によりリボソームタンパク質、rRNAやmRNAなどの周囲の環境と相互作用しペプチドアンチコドンの相対位置を調節することにより、正確なコドン識別に寄与していると結論づけられる(Fig.3A、B)。さらにRF-1とRF-2では識別の中心になる塩基の位置が異なることがわかったが、二種類の塩基を識別する位置が異なっていることが原因と考えられ、tRNAで見られるように厳格な識別をされる塩基と曖昧性を含む識別をされる塩基が存在することが強く示唆された。  図表Fig.3A ペプチド鎖解離因子7ドメインモデル / Fig.3B ドメインCによるペプチドアンチコドンの機能調節モデル 図表Fig.3A ペプチド鎖解離因子7ドメインモデル / Fig.3B ドメインCによるペプチドアンチコドンの機能調節モデル 本研究により、tRNAのみならずタンパク質であるRFにおいても「アンチコドン」を正しく運用するための機能領域の存在が初めて明らかになった。既に解析の進んでいるtRNAに加えて、RFによるコドンの解読機構が分子レベルで理解されるようになったことは大変意味のあることである。ペプチドアンチコドン調節領域の相互作用する因子および領域を特定することで、終結反応時のRFを含むAサイト内の機能的性質が明らかになってくると考えられ、さらにコドン識別からペプチド鎖解離までの信号伝達の解明にもつながると考えられる。また、ペプチドアンチコドンのコドン識別の特性が改変可能であることを実証したことは、タンパク工学などの応用面でも意義があると思われる。 本研究で明らかになったRFのコドン認識・識別機構やペプチジルトランスフェラーゼ中心活性化機構などのtRNAが機能する伸長過程との相同性から基本的には翻訳全体に共通した機構があることも示された。また、正しくアミノアシル化されEF-Tuによってリボソームに運ばれないと機能できないtRNAに対して、単独で機能できるRFは材料として大変有用であるといえる。現時点でペプチドアンチコドン、ペプチドアンチコドン調節領域、ペプチド鎖解離活性調節領域(2)が明らかになっており、今後RFの持ちうる機能を考える上でドメイン分割の概念を元にドメインとして捉えることで解析が進展すると考えられる。そしてRFの作用機構の詳細が解明されることで、終結反応から拡張して翻訳機構全体の理解につながることが期待できる。 参考文献(1)Ito,K.,Ebihara,K.,Uno,M.and Nakamura,Y.,Proc.Natl.Acad.Sci.U.S.A.,93:5443-5448(1996)(2)Uno,M.,Ito,K.and Nakamura,Y.,Biochimie,78:935-943(1996)(3)Ito,K.,Uno,M.and Nakamura,Y.,Proc.Natl.Acad.Sci.U.S.A.,95:8165-8169(1998)(4)Ito,K.,Uno,M.and Nakamura,Y.,Nature,403:680-684(2000) |