多細胞生物はしばしばあらかじめ決められた遺伝的プログラムに従って個体を構成する一部の細胞群を死滅させ、体制の構築や維持に役立てている。動物と同様、植物においても感染防御、緑葉の老化にともなう栄養分の転流、生殖細胞の形成・維持、通気組織形成、道管・仮道管形成などのさまざまな局面でプログラム細胞死が決定的な役割を果たしている。このうち道管や仮道管は維管束植物体の地上部に水分を供給する上で生育に不可欠であり、進化の上でも陸上植物の発達・繁栄に深く寄与した重要な組織である。それらの構成要素である管状要素は水輸送の駆動力となる強力な蒸散圧水流に耐えうるよう特殊化された二次細胞壁をもつ死細胞であって、その形成過程には最終的に細胞内容物の消化・消失に至るプログラムされた細胞死の機構が深くかかわっている。この細胞死機構は維管束植物の発生過程で根本的に重要な意味を持っていると考えられることから、均一な単離葉肉細胞から管状要素分化を高頻度・同調的に誘導できるヒャクニチソウ培養細胞系を用いて細胞生理学的、分子生物学的に解析することにした。 プログラムされた細胞死の過程では、実際の細胞死に先立ってしばしばオルガネラが特徴的な変化を示すことが明らかとなっている。動物細胞におけるミトコンドリアの膜電位の低下、染色質の凝縮、核の断片化、また植物の老化葉細胞における葉緑体の黄化などがその例である。管状要素分化過程においては、液胞の崩壊が細胞死の直接の引き金になっており、その他のオルガネラの崩壊は液胞崩壊の後で起こることが電子顕微鏡を用いた解析からすでに示されているが、それ以前に他のオルガネラの機能的側面にも変化が生じるかどうかは全く明らかでなっかた。そこでヒャクニチソウ培養細胞の核DNA、ミトコンドリア、液胞をそれぞれDAPI(4’,6-diamidino-2-phenylindole)、DiOC6(3,3’-dihexyloxacarbocyanine iodide)、Lucifer Yellowで生体染色し、葉緑体の自家蛍光も含めて分化途中の管状要素を観察した。その結果、二次壁肥厚を開始しているか液胞崩壊前の管状要素には、核DNA、ミトコンドリア、葉緑体由来の蛍光に顕著な変化は見られなかった(図1A)。Lucifer Yellowが細胞質に漏出する液胞崩壊直後でもミトコンドリアや葉緑体から蛍光が観察でき、核の断片化は起こらなかった(図1B)。さらに自己分解過程が進行すると、いずれのオルガネラからも蛍光が消失した。管状要素分化過程においては、動物細胞や老化葉肉細胞の細胞死とは異なる、液胞の崩壊が基礎となる植物特有の機構がはたらくことがわかった。 次に、具体的に液胞崩壊の機構を解析するため、崩壊以前の管状要素液胞の特異的な性質を探索した。まず、生体膜の選択的透過性の有無を基に細胞の生死を判定する色素、FDA(fluorescein diacetate)で管状要素を短時間(10分間)染色した。すると、細胞質のみが緑色に染色されるもの(図2b,t1)、細胞全体が黄色に染まるもの(図2d,t2)、全く染まらないもの(図2b,t3)の3通りのパターンが蛍光顕微鏡下で観察された。FDAは無極性分子で容易に細胞膜を通過し、細胞質内のesterase活性でfluoresceinに分解される。fluoresceinは中性pHの細胞質中で極性化し、膜を透過できなくなって細胞質内に保持されるが、膜の選択的透過性が失われていると拡散し、散逸する。したがってt1は生細胞、t3は死細胞と判定でき、t2は短時間で細胞全体が染まることから液胞膜の選択的透過性が消失した、すなわち液胞が崩壊した瞬間の細胞と考えられた。これらのパターンを示す細胞を培養過程で順次計数すると図3のようになり、最大で一度に20%程度の生きた管状要素が観察できること、二次壁形成開始後約6時間で液胞の崩壊が起こること、液胞の崩壊後は非常に短時間で細胞死に至ること、が明らかとなった。 FDAで細胞をさらに長時間(1時間)染色すると、管状要素でない細胞ではfluoresceinが液胞に輸送されて行くが、二次壁肥厚を開始した多くの管状要素ではこの輸送が起こらないことがわかった(図2,eとf)。これは管状要素の液胞がその崩壊以前に示す特異的な性質であり、液胞の崩壊にかかわっていると推察された。そこで培養開始後0時間および58時間目の細胞をFDAで染色し、液胞が蛍光を全く発しない細胞を経時的に計数した(図4)。培養開始直後の単離葉肉細胞や培養開始後58時間目の管状要素でない細胞では、30分から1時間以内にほぼすべての細胞の液胞中に蛍光が観察されるのに対し(図4,AとB)、培養開始後58時間目の分化途中の管状要素では、3時間染色しても60%で液胞の蛍光が観察されなかった(図4B)。fluoresceinを培養開始直後に加えた場合は、一度すべての細胞の液胞内に蛍光が観察されるが、後に二次壁肥厚した細胞の一部(10%)で観察されなくなった(図4C)。fluoresceinは細胞内有機物陰イオンの輸送マーカーになると考えられることから、ここで得られた結果は液胞の崩壊前に管状要素特異的に有機物陰イオンの液胞への輸送阻害と液胞からの排除が起こっていることを示唆した。液胞の性質変化は多くの管状要素でみられ、分化の進行に伴って顕著になっていくものと解釈された。 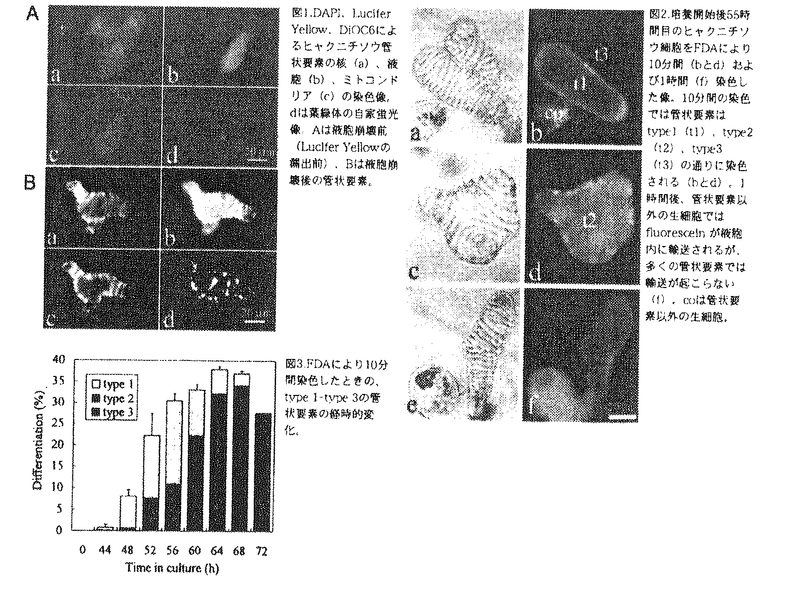 図表図1.DAPI、Lucifer Yellow,DiOC6によるヒャクニチソウ管状要素の核(a)、液胞(b)、ミトコンドリア(c)の染色像。dは葉緑体の自家蛍光像。Aは液胞崩壊前(Lucifer Yellowの漏出前)、Bは液胞崩壊後の管状要素。 / 図2.培養開始後55時間目のヒャクニチソウ細胞をFDAにより10分間(bとd)および1時開(f)染色した像。10分間の染色では管状要素はtype1(t1)、type2(t2)、type3(t3)の通りに染色される(bとd)。1時間後、管状要素以外の生細胞ではfluoresceinが液胞内に輸送されるが、多くの管状要素では輸送が起こらない(f)。coは管状要素以外の生細胞。 / 図3.FDAにより10分間染色したときのtype1-type3の管状要素の経時的変化。 図表図1.DAPI、Lucifer Yellow,DiOC6によるヒャクニチソウ管状要素の核(a)、液胞(b)、ミトコンドリア(c)の染色像。dは葉緑体の自家蛍光像。Aは液胞崩壊前(Lucifer Yellowの漏出前)、Bは液胞崩壊後の管状要素。 / 図2.培養開始後55時間目のヒャクニチソウ細胞をFDAにより10分間(bとd)および1時開(f)染色した像。10分間の染色では管状要素はtype1(t1)、type2(t2)、type3(t3)の通りに染色される(bとd)。1時間後、管状要素以外の生細胞ではfluoresceinが液胞内に輸送されるが、多くの管状要素では輸送が起こらない(f)。coは管状要素以外の生細胞。 / 図3.FDAにより10分間染色したときのtype1-type3の管状要素の経時的変化。 液胞へのfluoresceinの輸送は、有機物陰イオン輸送の阻害剤であるprobenecidによって阻害されることがわかっている。興味深いことに、probenecidはfluoresceinの液胞からの排除も促進する。そこでヒャクニチソウの培養系で約20%の細胞が分化を開始した51時間後に100 Mのprobenecidを添加し、FDAで染色して蛍光顕微鏡下で観察した。すると、通常6時間かかって細胞死に至るはずの管状要素がほぼ1時間以内に死に、管状要素でない細胞も相当の時間の遅れを経て最終的に死に至ることがわかった(図5)。次に、probenecid存在下での細胞形態を観察したところ、probenecidは管状要素でない細胞をもその液胞を膨張・崩壊させて(図6)死に至らしめることがわかった。これらの結果から液胞への有機物陰イオン輸送の阻害が液胞の崩壊を助長し、管状要素の細胞死を促進していると考えられた。 Mのprobenecidを添加し、FDAで染色して蛍光顕微鏡下で観察した。すると、通常6時間かかって細胞死に至るはずの管状要素がほぼ1時間以内に死に、管状要素でない細胞も相当の時間の遅れを経て最終的に死に至ることがわかった(図5)。次に、probenecid存在下での細胞形態を観察したところ、probenecidは管状要素でない細胞をもその液胞を膨張・崩壊させて(図6)死に至らしめることがわかった。これらの結果から液胞への有機物陰イオン輸送の阻害が液胞の崩壊を助長し、管状要素の細胞死を促進していると考えられた。 さらに、管状要素の液胞の性質変化と細胞死プログラムとの関係を調べるために、培養開始後50時間目の細胞を50 Mcycloheximideで処理し、FDA染色した後に観察した。cycloheximideは管状要素の細胞死、管状要素の液胞中へのfluorescein輸送阻害のいずれをも顕著に阻害した(図7)。この結果は管状要素液胞の性質変化が、細胞死の過程でプログラムされていることを強く示唆した。 Mcycloheximideで処理し、FDA染色した後に観察した。cycloheximideは管状要素の細胞死、管状要素の液胞中へのfluorescein輸送阻害のいずれをも顕著に阻害した(図7)。この結果は管状要素液胞の性質変化が、細胞死の過程でプログラムされていることを強く示唆した。 培養過程における管状要素分化の二つの重要な調節点は、それぞれ培養開始から36、48時間後より始まるTED3(細胞壁タンパク質と予想されている)、ZCP4(自己分解にかかわるタンパク質分解酵素)遺伝子mRNAの発現によって代表される。そこでこの2種のmRNAが系内に十分蓄積している時開(培養開始後57時間目)の細胞を1時間probenecid処理し、mRNAを抽出してgel-blot解析を行い、未処理の細胞(培養開始後58時間目)と比較した。その結果、probenecid処理によりTED3mRNAのレベルに変化はないが、ZCP4mRNAはほぼ消失することがわかった(図8)。この結果はprobenecidがZCP4mRNAを蓄積している一部の細胞を優先的に死滅させることを示唆している。管状要素の液胞はfluoresceinのような有機物陰イオン輸送能が低下することでprobenecidに対する感受性が高まると考えられるが、この性質変化は管状要素形成直前の調節点と関係していることが示された。 以上の結果を総合すると図9のようになる。培養系内では関連する現象が図9Aのようなタイムコースで起こる。型個別の管状要素についてみると、図9Bのように、二次壁肥厚開始およびZCP4遺伝子の発現とあいまって液胞膜を介した有機物陰イオンの輸送阻害が生じ、液胞が膨張し、その後液胞膜の選択的透過性消失、収縮・断片化が起こり、細胞内容物の自己分解につながっていくと考えられた。 probenecidは孔辺細胞を膨張させたままにするなど、細胞の浸透圧調節を攪乱することが知られている。したがってprobenecidはヒャクニチソウ細胞の液胞膜を介した有機物陰イオンの輸送を阻害することで膜内外の輸送系全体に影響を及ぼし、その結果浸透圧調節が麻痺して膜コンパートメントの膨張・崩壊を引き起こすと考えられる。管状要素は、この性質を利用して自らの液胞を崩壊させていると推察された。  図表図4.二次壁形成を開始した細胞によるfluoresceinの液胞への輸送阻害及び排除。培養開始後0時間目(A)、および58時間目(B)の細胞懸濁液に対しFDAを0.1 図表図4.二次壁形成を開始した細胞によるfluoresceinの液胞への輸送阻害及び排除。培養開始後0時間目(A)、および58時間目(B)の細胞懸濁液に対しFDAを0.1 g/ml加え、fluoresceinを液胞に全く含んでいない細胞の割合を管状要素とそうでない細胞で別々に計数した。また培養開始とともにFDAを加え,0、50、58時間後に観察した(C)。 / 図5.管状要素及びそれ以外の細胞への100 g/ml加え、fluoresceinを液胞に全く含んでいない細胞の割合を管状要素とそうでない細胞で別々に計数した。また培養開始とともにFDAを加え,0、50、58時間後に観察した(C)。 / 図5.管状要素及びそれ以外の細胞への100 M probenecidの作用。c25は処理せずに51時間から25時間培養を続けた細胞を指す。 / 図6.培養開始後55時間目の管状要素以外の細胞(aとb)、管状要素(cとd)、100 M probenecidの作用。c25は処理せずに51時間から25時間培養を続けた細胞を指す。 / 図6.培養開始後55時間目の管状要素以外の細胞(aとb)、管状要素(cとd)、100 M probenecidで処理した管状要素以外の細胞(eとf)の細胞質をFDAで染色した像。gとhは100 M probenecidで処理した管状要素以外の細胞(eとf)の細胞質をFDAで染色した像。gとhは100 M probenecidによって液胞崩壊を起こした細胞(右)液胞崩壊前の細胞(中)、死細胞(左)のFDAによる染色像。 / 図7.50 M probenecidによって液胞崩壊を起こした細胞(右)液胞崩壊前の細胞(中)、死細胞(左)のFDAによる染色像。 / 図7.50 M cycloheximideによる液胞崩壊およびfluoresceinの細胞への輸送阻害の抑制。培養開始後50時間目の細胞を50 M cycloheximideによる液胞崩壊およびfluoresceinの細胞への輸送阻害の抑制。培養開始後50時間目の細胞を50 M cycloheximideで処理し、FDAで1時間処理した後管状要素を染色パターンごとに計数し、細胞死を起こした管状要素、fluorescein液胞に含まない管状要素、fluoresceinを液胞に含む管状要素の割合を計算した。c9、c21は処理せずに50時間から9、21時間培養を続けた細胞を指す。 / 図8.probenecidが管状要素分化のマーカー遺伝子mRNAの蓄積パターンに及ぼす影響。培養開始後57時間目の細胞をprobenecidで1時間処理し(Probenecid+)、全RNAを抽出し、TED3およびZCP4遺伝子をprobeにしてRNAgel-blot解析を行い、末処理の細胞出来の全RNA(probenecid-)のパターンと比較した。 / 図9.管状要素の細胞死過程を示したモデル図。Aに培養系内に見られる現象、Bに管状要素に見られる現象を示す。影の領域はFDAを加えたときの、fluoresceinの管状要素内での分布を示す。a、管状要素形成前、b、二次壁形成、c、液胞の膨張、fluoresceinの液胞への輸送阻害、およびfluoresceinの液胞からの排除、d、液胞膜の選択的透過性の消失、e、液胞膜の収縮、断片化、f、死んだ管状要素。 M cycloheximideで処理し、FDAで1時間処理した後管状要素を染色パターンごとに計数し、細胞死を起こした管状要素、fluorescein液胞に含まない管状要素、fluoresceinを液胞に含む管状要素の割合を計算した。c9、c21は処理せずに50時間から9、21時間培養を続けた細胞を指す。 / 図8.probenecidが管状要素分化のマーカー遺伝子mRNAの蓄積パターンに及ぼす影響。培養開始後57時間目の細胞をprobenecidで1時間処理し(Probenecid+)、全RNAを抽出し、TED3およびZCP4遺伝子をprobeにしてRNAgel-blot解析を行い、末処理の細胞出来の全RNA(probenecid-)のパターンと比較した。 / 図9.管状要素の細胞死過程を示したモデル図。Aに培養系内に見られる現象、Bに管状要素に見られる現象を示す。影の領域はFDAを加えたときの、fluoresceinの管状要素内での分布を示す。a、管状要素形成前、b、二次壁形成、c、液胞の膨張、fluoresceinの液胞への輸送阻害、およびfluoresceinの液胞からの排除、d、液胞膜の選択的透過性の消失、e、液胞膜の収縮、断片化、f、死んだ管状要素。 |