| 内容要旨 | | 【序】植物細胞において分泌経路は,種々のタンパク質を小胞体,ゴルジ体,液胞,細胞外など決められた目的地に小胞によって輸送する.また,この経路は,タンパク質のみならず表層構築に必要な膜成分や細胞壁成分をも輸送する.したがって,植物細胞における分泌は,細胞骨格系と協力して,伸長方向の決定や分裂面の形成などに機能すると考えられる.本研究では,植物細胞で分泌経路を解析するにあたり,分泌経路の最初のステップであり,酵母における研究蓄積が豊富に存在する小胞体-ゴルジ体間のステップに焦点を当て,小胞体からの輸送小胞形成に必須な機能を担うと推定されるSar1 GTPaseに注目した. 酵母において,Sar1pは,小胞体からの輸送小胞形成を制御する重要な分子スイッチであり,正常な小胞体-ゴルジ体間輸送には,そのGTPaseサイクルの回転が必要不可欠である.そのため, Sar1pにGTP固定型変異,GDP固定型変異などが導入されると,このサイクルが回転せず,結果的に小胞体からの輸送小胞形成は起こらない.酵母における研究では,野生型酵母細胞内でこれらの変異Sar1pを条件的に発現させると野生型Sar1pの機能を阻害し,小胞体からの輸送小胞形成が停止すること,つまり優性阻害効果を持つことが証明されている.そこで,植物細胞において植物Sar1pの機能を明らかにするために,この分子遺伝学的手法を応用し,優性阻害型変異植物Sar1pが植物細胞内における小胞体-ゴルジ体間輸送にいかなる効果を持つか解析した(図1).  図1.優性阻害型変異植物Sar1pは,植物細胞内の小胞体-ゴルジ体間輸送にいかなる効果を持つか?図1上部のように,優性阻害型変異植物Sartpの条件的発現がOFFの時には,細胞内輸送は正常に行われているが,図1下部のように条件的発現がONになると,野生型植物Sar1pの機能を阻害し,小胞体からの輸送を停止させると考えられる. 図1.優性阻害型変異植物Sar1pは,植物細胞内の小胞体-ゴルジ体間輸送にいかなる効果を持つか?図1上部のように,優性阻害型変異植物Sartpの条件的発現がOFFの時には,細胞内輸送は正常に行われているが,図1下部のように条件的発現がONになると,野生型植物Sar1pの機能を阻害し,小胞体からの輸送を停止させると考えられる. 【結果と考察】(1)酵母細胞内における植物Sar1の機能解析Sar1pは,酵母の系において,小胞体からの輸送小胞の形成に必須な機能を担うことが証明されている.Sar1pは,まず,小胞体膜上に存在するグアニンヌクレオチド交換因子(GEF)であるSecl2pによって活性型であるGTP結合型に変換される.この変化によりCOPIIとよばれる一群のコートタンパク質(Sec23p/Sec24pとSecl3p/Sec31p)が小胞体膜上にリクルートし,小胞の出芽が始まる.小胞の出芽が完了すると,COPII構成因子であるSec23pがGTPase活性化タンパク質(GAP)として働き,Sar1pに結合しているGTPがGDPに加水分解され,COPIIが小胞から解離する.不活性型であるGDP結合型となったSar1pは,さらなる出芽のために小胞体膜上に戻る(図2).このようにSar1pは,小胞体からの輸送小胞形成を制御する重要な分子スイッチである.そこで,植物細胞の分泌経路を解析するにあたり,酵母における豊冨な研究蓄積から,植物内での小胞輸送を制御するツールとして植物のSar1pホモログが最も期待できると考えた.私は,修士課程において,タバコSAR1遺伝子のcDNAを単離し,それが酵母sar1欠失変異株を相補することを明らかにした.この相補は完全ではなく,温度感受性をおびていたが,植物でも植物SAR1が制御する分泌経路が存在することを示唆した.また,当研究室の多田は,修士課程において,タバコSAR1とシロイヌナズナSAR1のORFのみを発現させた場合に,いずれも酵母sar1欠失変異株を同程度に相補することを明らかにした(以後,タバコSAR1をNtSAR1,シロイヌナズナSAR1をAtSAR1と表記).この場合も相補は完全ではなく,温度感受性が残存していた.  図2.Sar1GTPaseによる小胞体からの輸送小胞の形成 図2.Sar1GTPaseによる小胞体からの輸送小胞の形成 次に私は,博士課程において,細胞内小胞輸送を制御するためにNtSAR1H74L,NtSAR1 D29G,AtSAR1 T51A,AtSAR1 D70V,AtSAR1 N129lという5タイプの優性阻害型変異植物SAR1を作製し,その効果を酵母内で検討した.これらのタイプの変異は,酵母SAR1において優性阻害効果を持つことが証明されているものである.まず,酵母野生株に,GAL1プロモーターの制御下でNtSAR1の野生型とその変異型H74L,D29G,AtSAR1の野生型とその変異型T51A,D70V,N129lを導入し,GAL1プロモーターの発現がONとなるガラクトース培地上で生育を観察した.このとき,NtSAR1H74LとAtSAR1 N129lを発現させた場合に顕著な増殖阻害が観察された(図3).また,植物SAR1の相補性を利用して,酵母SAR1を持たず,SAR1としては植物SAR1のみに依存して生育する酵母株,NtSAR1依存株とAtSAR1依存株を確立した.これらの株において同様の実験を行ったところ,NtSAR1依存株においては,NtSAR1 H74Lの発現は顕著な増殖阻害を,NtSAR1 D29Gの発現は弱い増殖阻害をもたらした.また,AtSAR1依存株においては,AtSAR1N129lの発現は顕著な増殖阻害を,AtSAR1T51Aの発現は弱い増殖阻害をもたらした(図3).これらの結果をまとめると表1のようになる.そこで,これらの増殖阻害の原因を探るため,酵母野生株において,  図3.酵母細胞内における優性阻害型変異植物SAR1の発現の効果.酵母の野生株,NtSAR1依存株とAtSAR1依存株にGAL1プロモーターの制御下でNtSAR1の野生型とその変異型H74L,D29G,AtSAR1の野生型とその変異型T51A,D70V,N129lを導入し,GAL1プロモーターの発現がONとなるガラクトース培地上で生育を観察した. 図3.酵母細胞内における優性阻害型変異植物SAR1の発現の効果.酵母の野生株,NtSAR1依存株とAtSAR1依存株にGAL1プロモーターの制御下でNtSAR1の野生型とその変異型H74L,D29G,AtSAR1の野生型とその変異型T51A,D70V,N129lを導入し,GAL1プロモーターの発現がONとなるガラクトース培地上で生育を観察した. 表1 優性阻害型変異植物SAR1の発現が酵母の生育に及ぽす効果 表1 優性阻害型変異植物SAR1の発現が酵母の生育に及ぽす効果 NtSAR1 H74Lが増殖阻害を及ぼしている時の細胞内輸送を酵母液胞タンパク質carboxypeptidase Y(CPY)をマーカーとしたパルスチェイス実験によって解析した.この結果,優性阻害型のNtSAR1H74Lを発現させた場合には,野生型NtSAR1を発現させた場合には検出されないCPYの小胞体型分子種(p1)の蓄積が観察され,小胞体からゴルジ体へと向かう輸送に損傷が生じていることが明らかになった(図4).  図4.酵母野生株においてNtSAR1 H74Lによる増殖阻害が生じている時点での細胞内輸送,酵母野生株において,NtSAR1 H74Lが増殖阻害を及ぼしている時の細胞内輸送を酵母液胞タンパク質carboxypeptidaseY(CPY)をマーカーとしたパルスチェイス実験によって解析した.この結果,優性阻害壁のNtSAR1 H74Lを発現させた場合には,野生型NtSAR1を発現させた場合には検出されないCPYの小胞体型分子種(p1)の蓄積が観察きれ,小胞体からゴルジ体への輸送に損傷が生じていることが明らかになった. 図4.酵母野生株においてNtSAR1 H74Lによる増殖阻害が生じている時点での細胞内輸送,酵母野生株において,NtSAR1 H74Lが増殖阻害を及ぼしている時の細胞内輸送を酵母液胞タンパク質carboxypeptidaseY(CPY)をマーカーとしたパルスチェイス実験によって解析した.この結果,優性阻害壁のNtSAR1 H74Lを発現させた場合には,野生型NtSAR1を発現させた場合には検出されないCPYの小胞体型分子種(p1)の蓄積が観察きれ,小胞体からゴルジ体への輸送に損傷が生じていることが明らかになった. (2)植物細胞内における植物Sar1の機能解析 植物細胞の分泌経路における小胞輸送を解析するためのマーカータンパク質として,GFP融合タンパク質を用いることにした.これにより,植物細胞を破壊せずに,生きたままの細胞においてリアルタイムに細胞内輸送を解析することが可能になった.植物が小胞体-ゴルジ体間輸送で機能していると推定されるため,ゴルジ体のシス領域に局在するタンパク質がマーカーとして最適であると考えた.ゴルジ体のシス領域に局在するタンパク質は,リサイクリングによって常時,ゴルジ体(シス)と小胞体の間を行き来しているが,ゴルジ体(シス)に存在する時間の方が小胞体に存在する時間よりも長いので,定常状態では,ゴルジ体(シス)に局在するように見えると考えられている(図5).また,そのため小胞体-ゴルジ体間輸送に損傷が生じれば,ただちに局在異常が生じると考えられる,実際には,マーカータンパク質として,シロイヌナズナのHDELB/KDELレセブターであるAtErd2とシロイヌナズナのRer1ホモログであるAtRer1 をGFP融合タンパク質の形で用いた.AtErd2-GFPの細胞内局在に関しては,C.Hawesらのグループによって,タバコの葉の表皮細胞においてゴルジ体に局在することが免疫電顕法で証明されている.また,AtRer1Bに関しては,当研究室の佐藤(健)によって酵母rer1欠失変異株を相補することが明らかにされており,酵母のゴルジ体(シス)に局在するRer1と機能的に保存されたホモログである. をGFP融合タンパク質の形で用いた.AtErd2-GFPの細胞内局在に関しては,C.Hawesらのグループによって,タバコの葉の表皮細胞においてゴルジ体に局在することが免疫電顕法で証明されている.また,AtRer1Bに関しては,当研究室の佐藤(健)によって酵母rer1欠失変異株を相補することが明らかにされており,酵母のゴルジ体(シス)に局在するRer1と機能的に保存されたホモログである.  図5.リサイクリング、ゴルジ体のシス領域に局在するタンパク質は,常時ゴルジ体(シス)と小胞体の間を行き来しているが、ゴルジ体(シス)に存在する時間の方が小胞体に存在する時間よりも長いので,定常状態では,ゴルジ体(シス)に局在するように見えると考えられている. 図5.リサイクリング、ゴルジ体のシス領域に局在するタンパク質は,常時ゴルジ体(シス)と小胞体の間を行き来しているが、ゴルジ体(シス)に存在する時間の方が小胞体に存在する時間よりも長いので,定常状態では,ゴルジ体(シス)に局在するように見えると考えられている. そこで,これらのマーカータンパク質と優性阻害型変異AtSar1(AtSar1 H74L)の両方を,同時に発現するブラスミドを作製した(図6).また,コントロールとなるマーカータンパク質と野生型AtSar1を発現するプラスミドも作製した(図6).これらのプラスミドを,タバコ培養細胞BY-2に対してはパーティクルガンを用いて,シロイヌナズナ培養細胞に対してはPEG法を用いて遺伝子導入し,一過的に発現させ,マーカーの局在を共焦点レーザー顕微鏡を用いて観察した.まず,AtErd2-GFP,AtErd2-GFP+AtSar1(WT),AtErd2-GFP+AtSar1 H74Lの3種類のプラスミドをBY-2細胞で発現させた. AtErd2-GFPとAtErd2-GFP+AtSar1(WT)を発現させた場合には,点状のゴルジ体に強いシグナルが観察され,同時に小胞体にも弱いシグナルが観察された(図7).これらは, C.Hawesらのグループが報告しているAtErd2-GFPのゴルジ体(シス)の局在パターンとよく一致していた.また,小胞体局在パターンのコントロールとしては,signalpeptide-GFP-HDELを用いた(図6,図8).これに対して,AtErd2-GFP+AtSar1 H74Lを発現させた場合には,大部分の細胞において,ゴルジ体の輝点はほぼ完全に消失し,小胞体の膜系に強い蛍光が観察された(図7).また,いくつかの細胞では,ゴルジ体の明るい輝点の数が減ってはいるが,まだ残存している像が観察された.これは,いくつかの細胞では,優性阻害型変異AtSar1による小胞体からの輸送阻害がまだ不完全であったためと考えている.また,AtErd2-GFPの局在パターンを,ゴルジ体(シス),小胞体(ほぼ完全にゴルジ体の蛍光は失われている),その中間(ゴルジ体の輝点が減少し,小胞体のシグナルが強くなって来ている)の3パターンに分け,パーティクルガンによる遺伝子導入後,3時間後と7時間後にプラスミドごとに各パターンの出現頻度を観察した(図9).それによると,優性阻害型変異AtSar1を発現させた場合には,遺伝子導入後3時間で,約8割の細胞で小胞体からの輸送がほぼ完全に阻害され,7時間後には.全ての細胞で輸送損傷が生じていることが明らかになった.また,輸送損傷が検出されるのは,優性阻害型変異AtSar1を発現させた時のみであった.また,AtErd2-GFPをBY-2細胞に導入後,プレフェルディンA(BFA)で処理すると,大部分のゴルジ体(シス)の輝点が消えて,小胞体の膜系が観察された(図10).BFAで処理した場合にも優性阻害型変異AtSar1を発現させた場合にも,AtErd2-GFPの局在が小胞体になることから、分泌阻害剤であるプレフェルディンAの効果と優性阻害型変異AtSar1の効果は,ともに小胞体-ゴルジ体間輸送に損傷を引き起こしているものと考えられる.また,同じ3種類のプラスミドをシロイヌナズナの培養細胞にPEG法で導入し,発現させたところ,AtErd2-GFPとAtErd2-GFP+AtSar1(WT)の場合には,ゴルジ体(シス)の局在パターンが, AtErd2-GFP+AtSar1 H74Lを発現させた場合には小胞体の局在パターンが観察され,ホモジェニックな系でも優性阻害型変異AtSar1の効果が観察された(図11).  図6.植物細胞に導入されたプラスミド、環状プラスミドの中で植物細胞内で発現される部分を図示した.CaMV35S:カリフラワーモザイクウイルス35SRNAプロモーター.TNOS: ノパリン合成酵素ターミネーター.SP:AtEXGTのシグナルペプチド.HDEL:小胞体局在化シグナル. 図6.植物細胞に導入されたプラスミド、環状プラスミドの中で植物細胞内で発現される部分を図示した.CaMV35S:カリフラワーモザイクウイルス35SRNAプロモーター.TNOS: ノパリン合成酵素ターミネーター.SP:AtEXGTのシグナルペプチド.HDEL:小胞体局在化シグナル. 図7.優性阻害型変異AtSar1によって生じたAtErd2-GFPの局在異常(タバコBY-2細胞).(A)AtErd2-GFP,(B)AtErd2-GFP+AtSar1(WT),(C)AtErd2-GFP+AtSar1 H74LをBY-2細胞で発現させた.AtErd2-GFPとAtErd2-GFP+AtSar1(WT)を発現させた場合には、点状のゴルジ体に強いシグナルが観察された.これに対して,AtErd2-GFP+AtSar1 H74Lを発現させた場合には、大部分の細胞において,ゴルジ体の輝点はほぼ完全に消失し,小胞体の膜系に強い蛍光が観察された. 図7.優性阻害型変異AtSar1によって生じたAtErd2-GFPの局在異常(タバコBY-2細胞).(A)AtErd2-GFP,(B)AtErd2-GFP+AtSar1(WT),(C)AtErd2-GFP+AtSar1 H74LをBY-2細胞で発現させた.AtErd2-GFPとAtErd2-GFP+AtSar1(WT)を発現させた場合には、点状のゴルジ体に強いシグナルが観察された.これに対して,AtErd2-GFP+AtSar1 H74Lを発現させた場合には、大部分の細胞において,ゴルジ体の輝点はほぼ完全に消失し,小胞体の膜系に強い蛍光が観察された.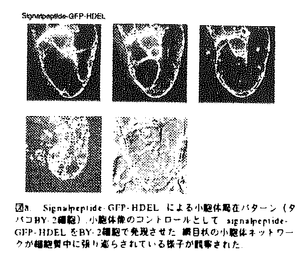 図8.Signalpeptide-GFP-HDELによる小胞体局在バターン(タバコBY-2細胞).小胞体像のコントロールとして signalpeptide-GFP-HDELをBY-2細胞で発現させた.網目状の小胞体ネットワークが細胞質中に張り巡らされている様子が観察された. 図8.Signalpeptide-GFP-HDELによる小胞体局在バターン(タバコBY-2細胞).小胞体像のコントロールとして signalpeptide-GFP-HDELをBY-2細胞で発現させた.網目状の小胞体ネットワークが細胞質中に張り巡らされている様子が観察された. 図9.AtErd2-GFPの局在に対する優性阻害型変異AtSar1の効果.AtErd2-GFP,AtErd2-GFP+AtSar1(WT),AtErd2-GFP+AtSar1 H74Lの3種類のプラスミドをBY-2細胞にパーチィクルガンを用いて導入した.AtErd2-GFPの局在パターンを,ゴルジ体(シス),小胞体(ほぼ完全にゴルジ体の蛍光は失われている).その中間(ゴルジ体の輝点が減少し,小胞体のシダナルが強くなっている)の3パターンに分け,遺伝子導入後,3時間後と7時間後にプラスミドでとに,30個の細胞を観察し各パターンの出現輝度を観察した. 図9.AtErd2-GFPの局在に対する優性阻害型変異AtSar1の効果.AtErd2-GFP,AtErd2-GFP+AtSar1(WT),AtErd2-GFP+AtSar1 H74Lの3種類のプラスミドをBY-2細胞にパーチィクルガンを用いて導入した.AtErd2-GFPの局在パターンを,ゴルジ体(シス),小胞体(ほぼ完全にゴルジ体の蛍光は失われている).その中間(ゴルジ体の輝点が減少し,小胞体のシダナルが強くなっている)の3パターンに分け,遺伝子導入後,3時間後と7時間後にプラスミドでとに,30個の細胞を観察し各パターンの出現輝度を観察した. 図10.AtErd2-GFPの局在に対するプレフェルディンA(BFA)の効果(タバコBY-2細胞).AtErd2-GFPをBY-2細胞で発現させ、プレフェルディンA(280 図10.AtErd2-GFPの局在に対するプレフェルディンA(BFA)の効果(タバコBY-2細胞).AtErd2-GFPをBY-2細胞で発現させ、プレフェルディンA(280 g/ml:150min)で処理した.この時,大部分のゴルジ体の輝点が消えて,小胞体の膜系が観察された. g/ml:150min)で処理した.この時,大部分のゴルジ体の輝点が消えて,小胞体の膜系が観察された. 図11.優性阻害型変異AtSar1によって生じたAtErd2-GFPの局在異常(シロイヌナズナ培養細胞).(A)AtErd2-GFP,(B)AtErd2-GFP+AtSar1(WT),(C)AtErd2-GFP+AtSar1 H74Lをシロイヌナズナ培養細胞で発現させた.AtErd2-GFPとAtErd2-GFP+AtSar1(WT)を発現させた場合には,ゴルジ体の輝点が観察されるゴルジ体(シス)局在パターンが,AtErd2-GFP+AtSar1 H74Lを発現させた場合には,小胞体局在パターンが観察された. 図11.優性阻害型変異AtSar1によって生じたAtErd2-GFPの局在異常(シロイヌナズナ培養細胞).(A)AtErd2-GFP,(B)AtErd2-GFP+AtSar1(WT),(C)AtErd2-GFP+AtSar1 H74Lをシロイヌナズナ培養細胞で発現させた.AtErd2-GFPとAtErd2-GFP+AtSar1(WT)を発現させた場合には,ゴルジ体の輝点が観察されるゴルジ体(シス)局在パターンが,AtErd2-GFP+AtSar1 H74Lを発現させた場合には,小胞体局在パターンが観察された. 次に,GFP-AtRer1Bをマーカーとして用い,GFP-AtRer1B,GFP-AtRer1B+AtSar1(WT),CFP-AtRer1B+AtSar1 H74Lの3種類のプラスミドをBY-2細胞で発現させた.この場合も,GFP-AtRer1BとGFP-AtRer1B+AtSar1(WT)を発現させた場合には,ゴルジ体(シス)の局在パターンが,GFP-AtRer1B+AtSar1 H74Lを発現させた場合には,小胞体の局在パターンが観察された(図12).以上の結果から,植物細胞における分泌経路において,優性阻害型変異植物Sar1p(AtSar1p)が,確かに小胞体からの輸送に損傷を与えること,つまり,植物Sar1pが小胞体からゴルジ体への輸送に機能していることが明らかになった.  図12.優性阻害型変異AtSar1によって生じたGFP-AtRer1Bの局在異常(タバコBY-2細胞).(A)GFP-AtRer1B,(B)GFP-AtRer1B+AtSar1(WT),(C)GFP-AtRer1B+AtSar1 H74LをBY-2細胞で発現させた.GFP-AtRer1BとGFP-AtRer1B+AtSar1(WT)を発現させた場合には,ゴルジ体の輝点が観察されるゴルジ体(シス)局在パターンが,GFP-AtRer1B+AtSar1 H74Lを発現させた場合には,小胞体局在パターンが観察された.まとめ 図12.優性阻害型変異AtSar1によって生じたGFP-AtRer1Bの局在異常(タバコBY-2細胞).(A)GFP-AtRer1B,(B)GFP-AtRer1B+AtSar1(WT),(C)GFP-AtRer1B+AtSar1 H74LをBY-2細胞で発現させた.GFP-AtRer1BとGFP-AtRer1B+AtSar1(WT)を発現させた場合には,ゴルジ体の輝点が観察されるゴルジ体(シス)局在パターンが,GFP-AtRer1B+AtSar1 H74Lを発現させた場合には,小胞体局在パターンが観察された.まとめ (1)酵母内において植物の優性阻害型変異Sar1の発現は,小胞体からゴルジ体への輸送に損傷を与えた. (2)植物細胞において植物の優性阻害型変異Sar1の発現は,小胞体からゴルジ体への輸送に損傷を与えた. (3)植物細胞において,植物Sar1の優性阻害型変異とGFP融合マーカータンパク質を一過的に共発現させて,人為的に小胞輸送を制御する系を構築した.今後、この方法論を他の輸送装置の解析に適用し,植物細胞における小胞輸送の分子機構の全体像を明らかにしていきたい. |