本論文は4章からなり、第一章では酵母26Sプロテアソームの調節因子の構成成分の一つをコードする遺伝子RPN9の分離とその欠失株( rpn9株)を用いた26Sプロテアソームの構造解析、第二章では rpn9株)を用いた26Sプロテアソームの構造解析、第二章では rpn9株の温度感受性増殖を利用して、 rpn9株の温度感受性増殖を利用して、 rpn9のマルチコピーサブレッサーおよび復帰変異を分離・解析した。第三章では rpn9のマルチコピーサブレッサーおよび復帰変異を分離・解析した。第三章では rpn9株が示す細胞周期制御の欠陥について解析し、M期中期から後期への移行には,従来から提唱されている因子以外に、未知の因子が関与することを予測している。第四章では、調節因子間の相互作用について遺伝学的な研究を行っている。以下に各車の内容を要約する。 rpn9株が示す細胞周期制御の欠陥について解析し、M期中期から後期への移行には,従来から提唱されている因子以外に、未知の因子が関与することを予測している。第四章では、調節因子間の相互作用について遺伝学的な研究を行っている。以下に各車の内容を要約する。 第一章Rpn9蛋白質の生化学的解析 RPN9は、ユビキチンレセプターをコードするRPN10をベイトとして用いたtwo-hybridスクリーニングで取得した遺伝子で、リッドの構成因子をコードしている。 rpn9株のプロテアソームを野生型のプロテアソームと比較してRpn9の機能を解析した。まず、 rpn9株のプロテアソームを野生型のプロテアソームと比較してRpn9の機能を解析した。まず、 rpn9株の細胞抽出液を10%-40%グリセロール密度勾配遠心分離法で分画した。合成基質であるSuc-LLVY-MCAを用いて各フラクションにおけるキモトリプシン様活性を測定した結果、 rpn9株の細胞抽出液を10%-40%グリセロール密度勾配遠心分離法で分画した。合成基質であるSuc-LLVY-MCAを用いて各フラクションにおけるキモトリプシン様活性を測定した結果、 rpn9株では野生型に比べ軽い画分に活性のピークが検出された。このピークは、明らかに野生型の26Sプロテアソームとは異なる複合体によるものと考えられた。そこで、この複合体を明確に26Sと分離するため、より分離度の高い方法としてネイティブゲル電気泳動を用いた。密度勾配遠心分離で粗分画したサンプルをネイティブゲル電気泳動によって分離し、泳動後の蛋白質をメンブレンに転写した。抗20Sプロテアソーム抗体を一次抗体にもちいてウエスタンプロッティングをおこなった結果、野生型株において移動度の異なる5本のバンドが検出された。ベースの抗体として抗Rpt1抗体,リッドの抗体として抗Rpn12抗体を一次抗体に用いたプロッティングの結果と比較し、移動度の小さな2本のバンドが対称および非対称の26Sプロテアソーム、中間の2本がリッドを持たないプロテアソーム、一番移動度の大きなバンドが20Sプロテアソームに相当すると考察した。この5本のバンドを指標にして rpn9株では野生型に比べ軽い画分に活性のピークが検出された。このピークは、明らかに野生型の26Sプロテアソームとは異なる複合体によるものと考えられた。そこで、この複合体を明確に26Sと分離するため、より分離度の高い方法としてネイティブゲル電気泳動を用いた。密度勾配遠心分離で粗分画したサンプルをネイティブゲル電気泳動によって分離し、泳動後の蛋白質をメンブレンに転写した。抗20Sプロテアソーム抗体を一次抗体にもちいてウエスタンプロッティングをおこなった結果、野生型株において移動度の異なる5本のバンドが検出された。ベースの抗体として抗Rpt1抗体,リッドの抗体として抗Rpn12抗体を一次抗体に用いたプロッティングの結果と比較し、移動度の小さな2本のバンドが対称および非対称の26Sプロテアソーム、中間の2本がリッドを持たないプロテアソーム、一番移動度の大きなバンドが20Sプロテアソームに相当すると考察した。この5本のバンドを指標にして rpn9株を調べたところ、 rpn9株を調べたところ、 rpn9株では移動度の小さな2本のバンドがほとんど検出されず、中間のバンドが顕著に強く検出された。泳動後のゲルにペプチダーゼ活性測定用の試薬を重屑し、ゲル内で活性を検出した結果、 rpn9株では移動度の小さな2本のバンドがほとんど検出されず、中間のバンドが顕著に強く検出された。泳動後のゲルにペプチダーゼ活性測定用の試薬を重屑し、ゲル内で活性を検出した結果、 rpn9株ではリッドを持たないプロテアソームに相当するバンドに活性が検出された。また,各フラクションに含まれる蛋白質をそれぞれSDS-PAGEで分離後、プロテアソーム構成因子に対する抗体を用いてウエスタンプロッティングした結果、 rpn9株ではリッドを持たないプロテアソームに相当するバンドに活性が検出された。また,各フラクションに含まれる蛋白質をそれぞれSDS-PAGEで分離後、プロテアソーム構成因子に対する抗体を用いてウエスタンプロッティングした結果、 rpn9株ではRpn10がプロテアソーム画分に検出されなかった。ベースの構成因子てあるRpt1をコードするRPT1遺伝子にHisタグを融合した株からNi-NTAビーズを用いてプロテアソームを沈降させる実験においても、 rpn9株ではRpn10がプロテアソーム画分に検出されなかった。ベースの構成因子てあるRpt1をコードするRPT1遺伝子にHisタグを融合した株からNi-NTAビーズを用いてプロテアソームを沈降させる実験においても、 rpn9株ではRpn10が沈降しないことが確認された。このことは,Rpn9がないときにはRpn10がプロテアソームに入り込めないことを示す結果である。以上の実験結果をまとめて,Rpn9が26Sプロテアソームを効果的に集合させるため、もしくは26Sブロテアソームを安定に保持するために必要であることを考察した。 rpn9株ではRpn10が沈降しないことが確認された。このことは,Rpn9がないときにはRpn10がプロテアソームに入り込めないことを示す結果である。以上の実験結果をまとめて,Rpn9が26Sプロテアソームを効果的に集合させるため、もしくは26Sブロテアソームを安定に保持するために必要であることを考察した。 第二章 rpn9株温度感受性の復帰変異の解析 rpn9株温度感受性の復帰変異の解析  rpn9株の温度感受性を抑圧する復帰変異株を解析することで温度感受性の原因を明らかにしようと試みた。復帰変異に対してネイティブゲル電気泳動、インゲルペプチダーゼ活性測定およびウエスタンブロッティングを行った結果, rpn9株の温度感受性を抑圧する復帰変異株を解析することで温度感受性の原因を明らかにしようと試みた。復帰変異に対してネイティブゲル電気泳動、インゲルペプチダーゼ活性測定およびウエスタンブロッティングを行った結果, rpn9株の示す構造的欠陥を回復しているものはなかった。マッピング、低コピーバンクDNAの導入により原因遺伝子を探索した結果、現在までに以下の変異を明らかにした。 rpn9株の示す構造的欠陥を回復しているものはなかった。マッピング、低コピーバンクDNAの導入により原因遺伝子を探索した結果、現在までに以下の変異を明らかにした。 group I)変異がセントロメアに近かったので、セントロメアマッピングをおこなった。その結果,7番染色体のセントロメアから約60kbの点にあるRPT6であることがわかった。アリルのひとつがR228Cのミスセンス変異であることを明らかにした。 group II)group IV変異と rpn9との3重変異にすると再び温度感受性を示すことから、3重変異に低コピーバンクを導入して高温で生育できる株を探索した。その結果RPT2を取得し、AAA型ATPaseの保存領域であるSRHにミスセンス変異を見つけた。SRH領域が複合体形成に必要であると考えられていることから、ベース複合体の構造が変化していると予想される。 rpn9との3重変異にすると再び温度感受性を示すことから、3重変異に低コピーバンクを導入して高温で生育できる株を探索した。その結果RPT2を取得し、AAA型ATPaseの保存領域であるSRHにミスセンス変異を見つけた。SRH領域が複合体形成に必要であると考えられていることから、ベース複合体の構造が変化していると予想される。 group VII)変異が劣性であったことから低コピーバンクDNAを導入し再び温度感受性になる株を探索した。取得したPUP2は20Sプロテアソームの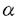 型サブユニットをコードする遺伝子で、遺伝子産物は20Sプロテアソームシリンダー構造の端に位置しており、ベースとのインターフェースを構成している。そこで、pup2変異がベースATPaseに作用し、何らかの形で活性を調節することにより温度感受性を回復するのではないかと予想された。 型サブユニットをコードする遺伝子で、遺伝子産物は20Sプロテアソームシリンダー構造の端に位置しており、ベースとのインターフェースを構成している。そこで、pup2変異がベースATPaseに作用し、何らかの形で活性を調節することにより温度感受性を回復するのではないかと予想された。 現在までに明らかにした変異がすべて26Sプロテアソームのベースに関与していることから、これらが復帰変異となる原因について、少量の26S様プロテアソームに含まれるベースが新たな活性を獲得することによるのではないかと考えている。 第三章プロテアソームと細胞周期制御 既に、 rpn9株が温度感受性を示し、制限温度に移行するとM期中期で細胞周期を停止することを明らかにした。本章においては細胞周期因子の分解に注目して、なぜM期中期で停止するかを明らかにしようと試みた。同じくプロテアソームのリッドの構成因子であるRpn12に変異をもつ株rpn12-1は温度感受性で、制限温度下ではG1/S、G2/Mの2点で細胞周期を停止する。このことを考慮すると、 rpn9株が温度感受性を示し、制限温度に移行するとM期中期で細胞周期を停止することを明らかにした。本章においては細胞周期因子の分解に注目して、なぜM期中期で停止するかを明らかにしようと試みた。同じくプロテアソームのリッドの構成因子であるRpn12に変異をもつ株rpn12-1は温度感受性で、制限温度下ではG1/S、G2/Mの2点で細胞周期を停止する。このことを考慮すると、 rpn9株ではS期インヒビターであるSic1pを分解できるが、その分解がM期後期への移行に必要であるPds1pの分解が遅延すること、rpn12-1ではそのどちらも分解できないことが予想された。この予想を確かめるべく、以下の実験をおこなった。 rpn9株ではS期インヒビターであるSic1pを分解できるが、その分解がM期後期への移行に必要であるPds1pの分解が遅延すること、rpn12-1ではそのどちらも分解できないことが予想された。この予想を確かめるべく、以下の実験をおこなった。 2-1)野生型株、 rpn9株およびrpn12-1株にそれぞれGAL10-SIC1-HA融合遺伝子をもつプラスミドを導入し試験株とした。 rpn9株およびrpn12-1株にそれぞれGAL10-SIC1-HA融合遺伝子をもつプラスミドを導入し試験株とした。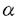 -factor処理により細胞をG1後期で同調し、ガラクトース添加にょりSic1を生産させた。その後菌体を洗浄して誘導を終了し、制限温度下で培養しながら経時的に細胞を回収した。これらのサンプルから細胞抽出液を調製しSDS-PAGEで蛋白質を分離した後、HAの抗体を用いたウエスタンプロッティングで細胞内のSic1を検出した。その結果、 -factor処理により細胞をG1後期で同調し、ガラクトース添加にょりSic1を生産させた。その後菌体を洗浄して誘導を終了し、制限温度下で培養しながら経時的に細胞を回収した。これらのサンプルから細胞抽出液を調製しSDS-PAGEで蛋白質を分離した後、HAの抗体を用いたウエスタンプロッティングで細胞内のSic1を検出した。その結果、 rpn9株では野生型株にやや遅れるものの、速やかに分解され、rpn12-1株ではほとんど分解されないことがわかった。この結果は、 rpn9株では野生型株にやや遅れるものの、速やかに分解され、rpn12-1株ではほとんど分解されないことがわかった。この結果は、 rpn9株が産生するごく少量の26S様プロテアソームがSic1を分解する活性をもつことを示している。 rpn9株が産生するごく少量の26S様プロテアソームがSic1を分解する活性をもつことを示している。 2-2)野生型株、 rpn9株およびrpn12-1株にそれぞれGAL1-PDS1-HA融合遺伝子をもつプラスミドを導入し試験株とした。ヒドロキシ尿素処理により、S期に細胞周期を停止させ、ガラクトース添加によりPDS1を発現させた。その後菌体を洗浄して誘導を終了し、制限温度下で培養しながら経時的に細胞を回収した。これらのサンプルから細胞抽出液を調製しSDS-PAGEで蛋白質を分離した後、HAの抗体を用いたウエスタンプロッティングで細胞内のPds1を検出した。その結果、野生型に比べ rpn9株およびrpn12-1株にそれぞれGAL1-PDS1-HA融合遺伝子をもつプラスミドを導入し試験株とした。ヒドロキシ尿素処理により、S期に細胞周期を停止させ、ガラクトース添加によりPDS1を発現させた。その後菌体を洗浄して誘導を終了し、制限温度下で培養しながら経時的に細胞を回収した。これらのサンプルから細胞抽出液を調製しSDS-PAGEで蛋白質を分離した後、HAの抗体を用いたウエスタンプロッティングで細胞内のPds1を検出した。その結果、野生型に比べ rpn9株、rpn12-1株ではPds1の分解が遅延していることがわかった。この実験により、上記の予想は支持された。また、これらの結果は rpn9株、rpn12-1株ではPds1の分解が遅延していることがわかった。この実験により、上記の予想は支持された。また、これらの結果は rpn9株が産土する26S様プロテアソームが野生型26Sプロテアソームとは異なった基質認識を行うことを示唆している。 rpn9株が産土する26S様プロテアソームが野生型26Sプロテアソームとは異なった基質認識を行うことを示唆している。 2-3)Pds1がM期中期停止を引き起こす原因となる唯一の基質ならば、 rpn9 rpn9 pds1二重遺伝子破壊株はM期中期を通過できると考えられる。そこで、二重変異株を作成し、細胞をG1後期に同調した後制限温度に移行させ、M期中期を通過するかどうか調べた。その結果、二重破壊株は、 pds1二重遺伝子破壊株はM期中期を通過できると考えられる。そこで、二重変異株を作成し、細胞をG1後期に同調した後制限温度に移行させ、M期中期を通過するかどうか調べた。その結果、二重破壊株は、 rpn9と同じようにM期中期停止を起こした。このことは、M期中期停止がPds1の分解遅延だけで起こるのではなく、何らかの因子が関与していることを示唆している。 rpn9と同じようにM期中期停止を起こした。このことは、M期中期停止がPds1の分解遅延だけで起こるのではなく、何らかの因子が関与していることを示唆している。 第4章rpn12-1変異と合成致死を示す変異の解析 調節因子中のサブユニット遺伝子の一つRPN12の温度感受性変異rpn12-1と合成致死を示す変異を分離し、その原因遺伝子を得ることで、Rpn12と関連する作用を持つ因子を同定することを目的とした。一つの変異株について、rpn12-1と合成致死をもたらす変異が染色体上の単一変異であることを遺伝学的方法により確認した後、原因遺伝子をクローニングした。その遺伝子はプロテアソームの構成因子の一つであるATPaseRpt1をコードすること、さらに、その変異部位を決定した。これにより、プロテアソーム調節因子サブユニットの内リッドの構成因子とベースの構成因子間の相互作用が検出された。 以上の研究内容について審査委員会で審議した。また、発表論文は共著で有るが、実験計画とその遂行は申請者によって行われたものであることも認められた。その結果、本研究は博士(理学)の学位に十分値するものであることが審査委員全員の一致により認められた。 |