太陽光に含まれる紫外線は、地球上の生物にとって太古の昔から主要な環境変異原である。紫外線照射によりDNA上に生じた損傷は、変異として蓄積すると細胞の癌化の原因となり、個体の生存を脅かす。そこで、生物はこの環境変異原からの防御システムとして、DNA損傷を修復する機構と、紫外線誘発アポトーシスにより損傷細胞を除去する機構を進化の過程で獲得してきた。本研究では、メダカ光回復酵素遺伝子を過剰発現し、高い光回復能をもつメダカ培養細胞OCP13を用いて、紫外線によるDNA損傷の認識からアポトーシスの実行までの機構を解析した。光回復酵素は紫外線によりDNA上に生成される主な損傷であるピリミジン二量体を、可視光のエネルギーのみを用いて特異的に修復する酵素で、大腸菌から有胎盤哺乳類を除く有袋哺乳類まで幅広い生物種で存在が確認されている。 紫外線は地上に届く太陽光に含まれる2種の波長域UVA(320-380nm)とUVB(290-320nm)と、地表には届かないUVC(200-290nm)に分類される。まず、損傷の種類とアポトーシスの関係を明らかにするため、様々な波長の紫外線により誘発されるアポトーシスを形態変化やCaspase-3様プロテアーゼ活性等の観点から比較した。OCP13細胞は、各波長の紫外線照射後4-8時間で形態変化とDNA断片化を示し、アポトーシスを起こすことが確認された。さらに、紫外線誘発アポトーシスは、細胞の形態変化の形状や時間経緯等の差によりUVA型とUVB/UVC型の2種類に分類できることが判明した。UVA誘発アポトーシスは、紫外線照射後の光回復処理により影響を受けないことからピリミジン二量体が原因ではないこと、そしてラジカルスカベンジャーであるN-acetylcysteine処理により阻害されることから酸化ストレスが原因であることが示唆された。一方、UVBやUVC照射により誘発されるアポトーシスは、ESS(Endonuclease Sensitive Site)法によりDNA損傷であるピリミジン二量体の生成が確認されたことと、光回復処理によりピリミジン二量体が修復されるとアポトーシスが回避されたことから、ピリミジン二量体が原因であることが明確になった。 Caspaseはアポトーシスにおいて中心的な役割を果たすcysteine protease familyである。これまでの報告から、Caspaseは下等な線虫からヒト、マウス等の補乳類にいたる種間で構造的にもまた機能的にもよく保存されており、その制御機構が進化上保存されてきたと考えられている。Caspase familyの中で特にアポトーシスの実行に関わるとされているものとしては、Caspase-3 sub-familyのCaspase-3、-7、-6がある。中でもCaspase-3、-7はアミノ酸配列DEVDを特異的に認識し切断する活性が強い。一般的にCaspase-3の活性化はCAD(caspase activated deoxyribonuclease)の活性化によるDNA断片化、laminやgelsolinの分解による細胞の形態変化などを引き起こし、アポトーシスを実行することが知られている。そこで、メダカ培養細胞においてDEVD-AMCを基質として用いてCaspase-3様のプロテアーゼ活性を測定した。OCP13細胞において、UVA誘発アポトーシス細胞ではDEVD切断活性は検出されなかったが、UVB/UVC誘発アポトーシス細胞では高いDEVD切断活性が検出された。すなわち、メダカ培養細胞において異なった損傷に起因する複数のアポトーシスカスケードの存在が示唆され、Caspase-3様プロテアーゼの活性化を伴わないアポトーシスも存在することが明らかになった。 次に、ピリミジン二量体が原因と考えられるUVC誘発アポトーシスにおけるCaspase-3様プロテアーゼの役割を明らかにするため、DEVD切断活性を測定した。OCP13細胞は、UVC照射後8時間で高いDEVD切断活性を示し、中でも培養皿から剥離してDNA断片化を起こしている細胞群が特に高い活性を持つことがわかった。これはDEVD切断活性によりCADが活性化されるという哺乳類細胞の知見に合致する。そして、UVC照射後の光回復によりアポトーシスを回避したOCP13細胞では、DEVD切断活性はUVC照射後光回復処理を行わない細胞より低く、非照射群と照射群の中間の値を示した。OCP13細胞の親株であるOL32細胞は、通常レベルでしか光回復酵素を発現していないため、本研究でのUVC照射量では光回復処理を行っても大部分のピリミジン二量体は修復されず、アポトーシスを回避できない。このOL32細胞ではDEVD切断活性は照射群と光回復処理群で差がなかった。これらの結果から、メダカ培養細胞においてDEVD切断活性がピリミジン二量体量により制御されていることが示唆された。 さらにメダカ培養細胞においてピリミジン二量体以外の刺激によるDEVD切断活性化を調べた。OCP13細胞では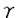 -線照射後8時間後に高いDEVD切断活性が検出され、DNA断片化を伴うアポトーシスを生じた。しかしRPMI saline(生理食塩水の一種)で細胞を培養すると、30分から1時間後に形態変化とDEVD切断活性の上昇が観測されたが、細胞の培養皿からの剥離やDNA断片化などのアポトーシスの兆候は見られなかった。 -線照射後8時間後に高いDEVD切断活性が検出され、DNA断片化を伴うアポトーシスを生じた。しかしRPMI saline(生理食塩水の一種)で細胞を培養すると、30分から1時間後に形態変化とDEVD切断活性の上昇が観測されたが、細胞の培養皿からの剥離やDNA断片化などのアポトーシスの兆候は見られなかった。 以上からUVBやUVCなどの紫外線照射によるピリミジン二量体や、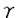 -線照射による損傷は、DEVD切断活性の増加を伴うアポトーシスを誘発するが、UVAによる酸化ストレスが誘発するアポトーシスはDEVD切断活性の上昇を伴わず、さらには、RPMI処理や光回復処理によりアポトーシスを回避した細胞のように、DEVD切断活性の上昇は起こるがアポトーシスを生じない場合もあることが判明した。すなわち、メダカの培養細胞では、Caspase-3様活性の上昇は必ずしも細胞の形態変化やDNA断片化等のアポトーシスの特徴を伴わないことがわかった。 -線照射による損傷は、DEVD切断活性の増加を伴うアポトーシスを誘発するが、UVAによる酸化ストレスが誘発するアポトーシスはDEVD切断活性の上昇を伴わず、さらには、RPMI処理や光回復処理によりアポトーシスを回避した細胞のように、DEVD切断活性の上昇は起こるがアポトーシスを生じない場合もあることが判明した。すなわち、メダカの培養細胞では、Caspase-3様活性の上昇は必ずしも細胞の形態変化やDNA断片化等のアポトーシスの特徴を伴わないことがわかった。 メダカにおいてCaspase-3 sub-familyのアポトーシスにおける役割を解析するため、degenerate PCR法により各遺伝子のクローニングを行った。その結果、OCP13細胞ではメダカcaspase-6、-7、-3A、-3Bが発現していることが判明した。ヒトの各Caspaseとのアミノ酸レベルでの相同性はそれぞれ63.0、63.5、53.7、63.3%だった。各々の活性中心のアミノ酸配列の比較から、基質の特異性も保存されていることが予想された。Alternative splicingではなくcaspase-3が複数種類発現していることが確認されたのは、メダカでの本研究が初めてである。 次に、これらメダカcaspase遺伝子の発現プラスミドを作成した。さらに、この発現プラスミドとpuromycin抵抗性遺伝子をもつプラスミドを、OCP13細胞にエレクトロポレーションでco-transfectionを行った。得られた細胞株をそれぞれOCASP-6、OCASP-7、OCASP-3A、OCASP-3Bと名付けた。OCASP-3A、OCASP-3B細胞は、親株であるOCP13細胞と比較し、各導入遺伝子の発現が約20倍、約2倍と高くなっていることをRT-PCRにより確認した。 各細胞株でDEVD切断活性を測定したところ、1)UVC照射後4-8時間で上昇すること、2)UVC照射線量に依存すること、3)UVC照射後の光回復処理により細胞がアポトーシスを回避した時のDEVD切断活性は、照射のみの場合と比較して低く、非照射と照射群の中間の値を示すことなどは、親株であるOCP13細胞と同じであった。哺乳類細胞で、Caspaseは前駆体として発現し、各種刺激により切断され活性型に成熟してアポトーシスを実行することが知られている。OCASP-3A、OCASP-3B細胞は、OCP13細胞と比較して非照射時のDEVD切断活性が高いが、細胞の形態はOCP13細胞と変わらないことから、過剰発現したCaspase-3A、-3Bが一部活性型で発現しているにも関わらず、細胞は正常に増殖することが判明した。UVC照射時、OCASP-7、OCASP-3A、OCASP-3B細胞は、OCP13細胞に比べてDEVD切断活性が有意に高いことから、過剰に発現したCaspase-7、-3A、-3BがUVC照射刺激により活性化されることが示唆された。一方、OCASP-6細胞ではUVC照射群のDEVD切断活性の値はOCP13細胞と変わらなかった。したがって、UVC照射によりOCP13細胞で検出されたDEVD切断活性は、メダカCaspase-7、-3A、-3Bの切断活性によるものであることが判明した。 さらに、Caspase阻害剤によりDEVD切断活性を阻害した細胞のアポトーシスを調べた。阻害剤であるAc-DEVD-CHOの20 Mまたは200 Mまたは200 M存在下で培養したOCP13細胞にUVC照射を行ったところ、8時間後のDEVD切断活性の上昇は抑えられたにも関わらず、細胞の形態変化やDNA断片化は阻害されなかった。すなわち、UVC誘発アポトーシスはDEVD切断活性に非依存的に生じることが明らかになった。 M存在下で培養したOCP13細胞にUVC照射を行ったところ、8時間後のDEVD切断活性の上昇は抑えられたにも関わらず、細胞の形態変化やDNA断片化は阻害されなかった。すなわち、UVC誘発アポトーシスはDEVD切断活性に非依存的に生じることが明らかになった。 以上のメダカcaspase遺伝子高発現細胞株を用いた実験から、メダカCaspase-3 sub-familyはUVC照射によりDNA上に生成されたピリミジン二量体の存在により活性化されるが、哺乳類細胞とは異なり、UVC誘発アポトーシスにおける細胞形態の変化や細胞の培養皿からの剥離、DNA断片化には関与していないことが明らかになった。 |