| 内容要旨 | | 陸上植物の進化の過程で維管束植物は、配偶体世代が縮小し胞子体世代が優占するようになり、また、水や養分を効率的に輸送する組織である維管束系を発達させた。一方、陸上植物の進化過程の初期に維管束植物と分岐したコケ植物のセン類、タイ類、ツノゴケ類では配偶体が優占する世代交代を行っており、セン類、タイ類に見られるhydroid,leptoidは維管束植物の管状要素,篩要素とは異なった細胞学的な特徴をもつなど、表現形質に大きな違いがある。このような表現型上の差異は、進化する実体である遺伝子のレベルで理解されるべきである。遺伝子のどのような違いが配偶体の縮小と胞子体の生長様式の違いを生み出したのか、hydroidと管状要素はどのような遺伝子によって作られているのかというような問題に答えるためには現在研究が進んでいる被子植物とともにコケ植物においても分子遺伝学的な解析を行う必要がある。 セン類のヒメツリガネゴケPhyscomitrella patensは植物体の大きさが数mmと小さく、世代時間が試験管内で3ヶ月程度であり、半数体で表現型が観察できるので古くから遺伝学的な研究に用いられてきた。近年、形質転換系が確立され、相同組換えを介した遺伝子ターゲティングが可能であることが判明し、分子遺伝学的研究の材料として注目を集めるようになってきた。 ヒメツリガネゴケでは、相同組換えによって、配列既知の遺伝子の機能を解析するのは容易である一方、遺伝子地図がなく、突然変異体からその原因遺伝子を単離・同定する事は困難であった。しかしながら、維管束植物の胞子体を作っている遺伝子の相同遺伝子がコケ植物の配偶体を作っているとは限らないので、コケ植物であるヒメツリガネゴケにおいて遺伝子を単離する系の開発が望まれる。 シロイヌナズナ等の被子植物においては、T-DNAタギング等によって多くの変異体の原因遺伝子が単離されてきた。さらに、ジーシトラップ等により、組織特異的に発現する遺伝子の単離が行われている。 そこで、本研究ではセン類のヒメツリガネゴケのタグ付き変異体ライブラリー、ジーントラップ系統を作成し、変異体から遺伝子を単離することが可能な系の開発を試みた。 出芽酵母においてはシャトルミュータジェネシスという相同組換えを利用して挿入配列を導入する方法が用いられている。これはプラスミドにクローニングしたゲノム断片上に大腸菌内でトランスポゾンを転移させ、得られたプラスミドを宿主に形質転換することによって実現されている。ヒメツリガネゴケは出芽酵母と同程度に相同組換えの効率が高いのでこの方法を適用することができると考えた。 植物用選択マーカーとしてCaMV35Sプロモーターの制御下でnptllを発現させるカセットを用いたミニトランスポゾンを作成した(図1A)。さらに、ジーントラップが可能になるように発現マーカーとして -glucronidase(GUS)をコードするuidA遺伝子の5’末端にヒメツリガネゴケのcdc2遺伝子のイントロンを融合させたものを含むトラシスポゾンを作成した(図1B,C)。 -glucronidase(GUS)をコードするuidA遺伝子の5’末端にヒメツリガネゴケのcdc2遺伝子のイントロンを融合させたものを含むトラシスポゾンを作成した(図1B,C)。 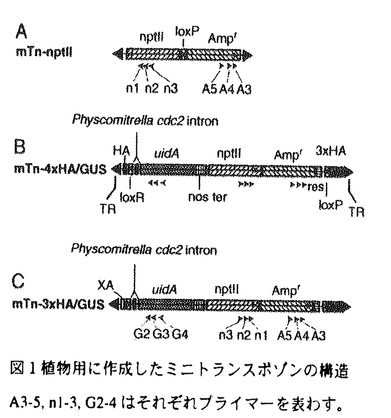 図1 植物用に作成したミニトランスポゾンの構造A3-5,n1-3,G2-4はそれぞれプライマーを表わす。 図1 植物用に作成したミニトランスポゾンの構造A3-5,n1-3,G2-4はそれぞれプライマーを表わす。 このトランスポゾンの転移先となるゲノムライブラリーをプラスミドpHSS-Salを用いて作成した。そして、このトランスポゾンがランダムに転移するかを調べる実験を行ない、ランダムに転移することを確認した。 トランスポゾシをライブラリーに転移させ、このライブラリーから抽出したDNAを用いてヒメツリガネゴケを形質転換した。得られた形質転換体がら形態に異常の見られる変異体を選抜したところ、いくつかの変異体が得られた。例えば、TN1は茎葉体全体が小さくなる変異体である(図2B)。TN2は原糸体、茎葉体ともに、褐色の色素が蓄積され、茎葉体の発生は高々2枚の葉を形成した段階で停止する。その葉においても葉緑体が発達せず、褐色の色素の細胞壁への沈着が見られる(図2C)。 また、48系統についてGUSの組織化学的染色を行ない、10系統のGUS発現個体を得た。199905310439は粘毛(mucilage hair)に特異的な染色が見られる系統(図2D,E)、199905310433は原糸体全体に発現が見られる系統である(図2F)。  図2 シャトルミュータジェネシスによって得られた変異体とGUS発現個体。A,野生型;B,TN1;C,TN2; D,E,199905310439;F,199905310433。AとBは同倍率 図2 シャトルミュータジェネシスによって得られた変異体とGUS発現個体。A,野生型;B,TN1;C,TN2; D,E,199905310439;F,199905310433。AとBは同倍率 形態の変異体及び、変異の見られない任意の系統からゲノムDNAを抽出し、サザンハイブリダイゼーションによって、ゲノムに組み込まれたトランスポゾンを検出した。その結果、多くの系統で、複数コピーのトランスポゾンが組み込まれていることがわかった(図3左)。ヒメツリガネゴケにおいては、タンデムに複数コピーの導入DNAが組み込まれる例が報告されている。そこで、今回検出された複数のコピーも近接して組み込まれたものであるかを調べる実験を行なった。トランスポゾンの両端付近に外向きに設計したプライマーを用いたPCRによってPCR産物の増幅が見られるかを調べた。近接した領域にトランスポゾンが組み込まれているならば、増幅が見られ、独立に組み込まれている場合には増幅が見られないことが予想される。複数コピーが検出された13系統のうち12系統で増幅が認められた。一方、単一コピーの組み込みであると推定された2系統ではPCR産物の増幅は見られなかった。 さらに、変異系統TN1について、そのトランスポゾン間領域を単離する実験を行なった。トランスポゾンの周辺にはゲノムライブラリーに含まれていたゲノム配列があり、そのゲノム領域に相同組換えによってトランスポゾンが組み込まれていることが期待される。70クローンをPCR-RFLPによって分類し、末端の塩基配列を決定した結果16タイプのクローンが得られた。そのうちの13タイプはヒメツリガネゴケゲノムの配列を持ち、残りの3タイプはゲノムライブラリーを作成するのに使ったベクターpHSS-Salを部分的に持っていた。そのゲノム配列が多数組み込まれているかどうかを調べるため、13タイプのうち最長のクローンのゲノム配列2.7kbをプローブにしてサザンハイブリダイゼーションを行なったところ、TN1では多数のバンドが検出され(レーン6)、野生型及び他の形質転換体では一本のバンドが検出された(図3右)。  図3 形質転換体のサザンハイブリダイゼーション導入したトランスポゾンを検出したもの(左)と形質転換体TN1から回収された2.7kbのゲノム断片 図3 形質転換体のサザンハイブリダイゼーション導入したトランスポゾンを検出したもの(左)と形質転換体TN1から回収された2.7kbのゲノム断片 得られた配列をもとに、ゲノムライブラリーから当該クローンのほぼ全体をPCRによって増幅・単離し、塩基配列を決定した。ゲノムクローンの配列と13タイプの配列を比較すると、13タイプすべてがゲノムクローンの一部を持つクローンであった(図4)。  図4 形質転換体からPCRによって回収された断片の模式図 図4 形質転換体からPCRによって回収された断片の模式図 このことから、他の位置に少数の組み込みがある可能性は否定できないものの、サザンハイブリダイゼーションによって検出される多数のバンドは単一のゲノムクローンに由来する配列が一ヶ所に重複して組み込まれている可能性が高いと考えられる。 複数のトランスポゾンとゲノム配列が一ヶ所に組み込まれる機作については、断片同士のライゲーションが起きた時に期待されるキメラや、独立な組込みがある時に期待される異なるゲノム断片を持つクローンが単離されなかったことから、異なる位置にトランスポゾンが挿入された単一クローン由来のDNA断片同士の相同組換えが有力であると考えられる。 得られた配列をデータベースの配列と比較した結果、機能未知の遺伝子と高い相同性を示す配列を含んでいた。この遺伝子は、今回取られたセン類のヒメツリガネゴケ、裸子植物のテーダマツ、被子植物と、遠縁の植物間でよく保存されていることから重要な機能を持っていると予想される。一方、全ゲノムが決定されている出芽酵母・センチュウのゲノム配列上に類似配列がないことから、植物に特異的な機能を担っている遺伝子であると予想される。 本研究では、ヒメツリガネゴケにおいて、シャトルミュ-タジェネシスを利用することにより、初めて形質転換による変異体を得ることに成功し、ヒメツリガネゴケからの遺伝子単離の道を開いた。ジーントラップにより、組織特異的発現を示す系統の作出に成功した。今後、ジーントラップ系統の数を増やすことにより、様々な組織を識別するマーカーが得られると期待される。 このタギング系の開発により、コケ植物から遺伝子を単離して維管束植物の相同遺伝子と比較することが可能になり、陸上植物の進化の研究に貢献すると期待される。 |
| 審査要旨 | | 本論文は4章からなり,第1章は序論,第2章はタグ付き変異体ライブラリーの作出,第3章はシャトルミュータジェネシスによる変異体の分子生物学的解析,第4章は考察について述べられている.第1章では,陸上植物の進化を解明することを目指して,陸上植物の4群の中で原始的特徴を保存しているコケ植物の分子遺伝学的研究を推進するために,新たな解析系を開発するという本研究の目的が述べられている. 第2章はタグ付き変異体ライブラリーを作出できる解析系を開発した実験結果が述べられている.コケ植物(セン類)のヒメツリガネゴケは古くから遺伝学的研究に利用されている植物であり,相同組換えによって配列既知の遺伝子の機能を解析するのは容易であるが,突然変異体からその原因遺伝子を単離・同定することは困難であった.本研究はこの困難な状況を打破し,分子遺伝学的解析ができるように,同程度に相同組換えの効率が高い出芽酵母で用いられているシャトルミュ-タジェネシスの方法をヒメツリガネゴケに適用することを試みた. 開発の第1歩として,植物用選択マーカーとしてCaMV35Sプロモーターの制御下でnptllを発現させるカセットを用いたミニトランスポゾンを作成した.そして,ジーントラップが可能になるように発現マーカーとして -glucronidase(GUS)をコードするuidA遺伝子の5’末端にヒメツリガネゴケのcdc2遺伝子のイントロンを融合させたものを含むトランスポゾンを作成した.さらに,このトランスポゾンの転移先となるゲノムライブラリーをプラスミドpHSS-Salを用いて作成し,このトランスポゾンがランダムに転移することを確認した. -glucronidase(GUS)をコードするuidA遺伝子の5’末端にヒメツリガネゴケのcdc2遺伝子のイントロンを融合させたものを含むトランスポゾンを作成した.さらに,このトランスポゾンの転移先となるゲノムライブラリーをプラスミドpHSS-Salを用いて作成し,このトランスポゾンがランダムに転移することを確認した. トランスポゾンをライブラリーに転移させ,そこから抽出したDNAを用いてヒメツリガネゴケを形質転換した.得られた形質転換体からいくつかの変異体を得た.その変異体の1つTN1は茎葉体全体が小さかった.また,48系統についてGUSの組織化学的染色を行ない,10系統のGUS発現個体を得た. このように,ヒメツリガネゴケにおいてシャトルミュ-タジェネシスによって遺伝子をタギングする系を開発するのにはじめて成功した. 第3章は得られた変異体を分子生物学的に解析した結果が述べられている.形態の変異体及び,変異の見られない任意の系統からゲノムDNAの抽出と,サザンハイブリダイゼ-ションによって,複数コピーのトランスポゾンがゲノムに組み込まれており,しかもほとんどの場合近接して組み込まれていることを確かめた.さらに,変異系統TN1について,そのトランスポゾン間領域を単離して得た複数のタイプのクローンはヒメツリガネゴケゲノムの配列をもち,検出された多数のバンドはおそらく単一のゲノムクローンに由来する配列が1カ所に重複して組み込まれたことを示す結果を得た.これは,異なる位置にトランスポゾンが挿入された単一クローン由来のDNA断片同士の相同組換えによるとみるのが妥当であると述べている. 得られたTN1遺伝子の配列をデータベースの配列と比較し,機能未知の遺伝子と高い相同性を示す配列を含むことを示した.この遺伝子は,今回取られたセン類のヒメツリガネゴケと種子植物の遠縁の植物間でよく保存されていることから,植物に特異的で重要な機能を担っていると予想した. 第4章はヒメツリガネゴケでシャトルミュータジェネシスにより初めて形質転換による変異体を得ることに成功し,このコケ植物から遺伝子を単離する道を開き,さらにジーントラップにより組織特異的発現を示す系統の作出に成功したことをふまえ,今後予想される研究の展開を考察した. 本論文は,独自のタギング系の開発によりコケ植物から遺伝子を単離して維管束植物の相同遺伝子と比較することをはじめて可能にし,それによって陸上植物の進化に関する分子遺伝学的研究に大きく貢献すると期待される優れた論文であると審査委員全員が判断した. なお,本論文の大部分は,論文提出者・日渡祐二・榊原恵子・加藤雅啓・長谷部光泰の共同研究であるが,論文提出者が主体となって分析及び検証を行ったもので,論文提出者の寄与が十分であると判断する. したがって,博士(理学)の学位を授与できると認める. |