魚肉は、良質なタンパク質の供給源であるが、加工形態としては塩ずりで溶出した筋肉タンパク質を加熱ゲル化させたねり製品が最も多くを占める。数多い魚肉ねり製品の原料魚のうち、加熱ゲル形成能の高い肉質をもつシログチが、重要な位置を占めている。しかしながら、その漁獲量は極端に少なく、加工業者の要求に十分に応えられないのが現状である。このため、一般のねり製品の原料には、シログチより肉質の劣るスケトウダラから調製した冷凍すり身が多く用いられている。一方、このような原料魚種によるねり製品の品質の差が、筋肉タンパク質のどのような性状に基づくのかは不明で、水産物の利用加工上大きな問題となっている。 このような背景の下、本研究ではまず、シログチ普通筋を対象に、筋肉タンパク質の主成分であるミオシンのうち重鎖の一次構造を決定し、既報のスケトウダラや他脊椎動物種のものと比較検討を行った。さらに、遺伝子工学的手法を用いてシログチ・ミオシン重鎖のフラグメントを発現させ、その熱力学的性状を解析したもので、得られた研究成果の大要は以下の通りである。 1.シログチ普通筋ミオシン重鎖のcDNAクローニング ミオシンは分子量約50万の巨大タンパク質で、分子量約20万の重鎖サブユニット2本と分子量約2万の軽鎖サブユニット4本から構成される。ミオシン分子はさらに、機能および構造的に重鎖のN末端側約半分からなり軽鎖を結合している球状のサブフラグメント-1(S1)と、重鎖のC末端側約半分からなる線維状のロッドに分けられる。ロッドはさらにC端側のL-メロミオシン(LMM)と、このフラグメントとS1をつなぐサブフラグメント-2(S2)からなる。本研究ではまず、シログチ普通筋ミオシン重鎖の一次構造を、cDNAの塩基配列から演繹することを試みた。 東京湾で捕獲したシログチ(Pennahia argentata)活魚(平均体重約320g)から普通筋を採取し、約1gの大きさに細切して、液体窒素中で急速凍結した。凍結試料は、使用まで-80℃に保管した。次に、凍結試料から常法により全RNAを抽出し、Pharmacia社製mRNA purification kitを用いてmRNAを精製した。さらに、同社製Time saver cDNA synthesis kitおよび付属のランダムプライマーを用いてcDNAを合成した。次に、合成したcDNAにEcoRIリンカーを付加し、ファージベクター ZAPIIに挿入して、cDNAライブラリーを構築した。このライブラリーにつき、既存の抗コイ普通筋ミオシン抗体を用いてスクリーニングを行い、得られたクローンの塩基配列を決定した。なお、得られた最長のクローンでもミオシン重鎖の全領域をコードしていなかったことから、末決定領域はRT-PCR法および5’-RACE法を用いてDNA断片を増幅し、pBluescript IISK-にサブクローン化した後、塩基配列を決定した。 ZAPIIに挿入して、cDNAライブラリーを構築した。このライブラリーにつき、既存の抗コイ普通筋ミオシン抗体を用いてスクリーニングを行い、得られたクローンの塩基配列を決定した。なお、得られた最長のクローンでもミオシン重鎖の全領域をコードしていなかったことから、末決定領域はRT-PCR法および5’-RACE法を用いてDNA断片を増幅し、pBluescript IISK-にサブクローン化した後、塩基配列を決定した。 以上のようにクローン化したシログチ普通筋ミオシン重鎖のcDNAは5,983塩基からなり、1,930アミノ酸をコードしていた。また、5’および3’末端側は、それぞれ64および129塩基の非翻訳領域を含み、3’非翻訳領域にはポリアデニレーションシグナルおよびポリAテールが含まれていた。 2.シログチ普通筋ミオシン重鎖の一次構造 演繹されたシログチ普通筋ミオシン重鎖の一次構造につき、親水性および疎水性アミノ酸残基の出現パターンを調べたところ、S1領域では両グループの混在することが分かった。一方、S2およびLMM領域はいずれも親水性の特性を示した。 次に、シログチ普通筋ミオシン重鎖の一次構造につき、その特徴を他脊椎動物種のものと比較した。まず、シログチS1重鎖領域の演繹アミノ酸配列は、既報のスケトウダラ普通筋のものと88.0%の相同性を示した。また、10℃および30℃馴化コイに主成分として含まれる10℃および30℃型普通筋ミオシン・アイソフォームのS1重鎖とは、それぞれ81.7および83.2%の相同性であった。さらに、恒温動物のニワトリおよびウサギ速筋のものとは、それぞれ79.5および78.8%の相同性を示した。したがって、シログチS1重鎖は魚類のスケトウダラのものと最もよく類似し、恒温動物のものとは大きく異なることが明らかとなった。 次に、シログチS2領域の比較を行ったところ、スケトウダラ、コイ10℃型、コイ30℃型、ニワトリ、およびウサギのものと、それぞれ91.6、92.8、93.9,84.8、および85.3%の相同性を示した。したがって、シログチS2領域はコイ30℃型と最もよく類似することが分かった。さらに、シログチLMMは、前述のS1重鎖およびS2の動物種順に、それぞれ91.0、88.8、91.5、79.1、および80.1%の相同性を示し、したがってコイ30℃型LMMと最もよく類似した。 ところで,ミオシンのロッド部分は、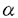 らせんからなる2本の分子が互いに絡まり合った、二重コイルの線維状構造をとることが既に明らかにされている。この構造をとるため、ロッドの一次構造は特徴的なアミノ酸7残基周期の繰り返し構造(a,b,c,d,e,f,およびg)を示す。aおよびdには疎水性アミノ酸が、b、c、およびfには電荷をもつアミノ酸が多く配置し、二重コイル構造を安定化している。さらにロッドには、この4倍の28残基周期の繰り返し配列がみられ、この周期性がミオシンのフィラメント形成能に重要であると考えられている。 らせんからなる2本の分子が互いに絡まり合った、二重コイルの線維状構造をとることが既に明らかにされている。この構造をとるため、ロッドの一次構造は特徴的なアミノ酸7残基周期の繰り返し構造(a,b,c,d,e,f,およびg)を示す。aおよびdには疎水性アミノ酸が、b、c、およびfには電荷をもつアミノ酸が多く配置し、二重コイル構造を安定化している。さらにロッドには、この4倍の28残基周期の繰り返し配列がみられ、この周期性がミオシンのフィラメント形成能に重要であると考えられている。 そこで、シログチ普通筋S2のアミノ酸配列を、上述の繰り返しユニットとして整列してみたところ、aとdの位置には疎水性アミノ酸残基が高い頻度で配置した。また,28残基の周期をもとに荷電アミノ酸の分布を調べたところ、正および負に荷電した領域が交互にみられ、ミオシン・ロッドに特徴的な構造が確認された。 次に、シログチ普通筋LMMの7残基の繰り返し構造を調べた結果、S2と同様にaとdの位置には疎水性アミノ酸残基が高い頻度で配置した。また、b,c、およびfには荷電アミノ酸残基が多く配置し、既報のコイ、スケトウダラ、ウサギのLMMとよく類似した傾向を示した。また、シログチLMMはスケトウダラのそれに比べて、b、c、およびfの位置に荷電アミノ酸残基がより多くみられた。このことから、これら荷電アミノ酸の配置が、両魚種ミオシン間のゲル形成能の差に何らかの影響を及ぼしている可能性が示唆された。 3.シログチ普通筋LMMの熱力学的性状 前述のように、LMMはミオシン重鎖のC末端側に位置し、ミオシンのフィラメント形成に重要な役割を果たすことが知られている。また、本研究から、シログチLMMはスケトウダラのものと比べてアミノ酸7残基繰り返し構造中b、c、およびfの位置に荷電アミノ酸が多く配置し、両魚種ミオシンの性状の差異に影響を及ぼすことが示唆された。そこで、大腸菌の発現系を用いてシログチLMMを発現させ、その熱力学的性状を解析した。 まず、制限酵素NheIおよびBamHIの認識配列をもつプライマーを用いて、シログチLMMの全長をコードするDNA断片をPCRにより増幅した。次に、増幅断片を両制限酵素で処理した発現用プラスミドベクターpET-11a(Novagen社製)に挿入し、宿主大腸菌BL21(DE3)pLysSを形質転換した。大腸菌を大量培養した後、isopropyl- -D-thiogalactopyranosideを添加し、LMMの発現を誘導した。次に、大腸菌を集菌した後、超音波破砕し、発現タンパク質を菌体内から抽出した。さらに、抽出したタンパク質を、低イオン強度および高イオン強度の緩衝液に透析する操作を繰り返して塩溶性のLMMを粗精製した後、DEAE-Toyopearl 650M陰イオン交換カラムクロマトグラフィーにより、高純度の標品を得た。 -D-thiogalactopyranosideを添加し、LMMの発現を誘導した。次に、大腸菌を集菌した後、超音波破砕し、発現タンパク質を菌体内から抽出した。さらに、抽出したタンパク質を、低イオン強度および高イオン強度の緩衝液に透析する操作を繰り返して塩溶性のLMMを粗精製した後、DEAE-Toyopearl 650M陰イオン交換カラムクロマトグラフィーにより、高純度の標品を得た。 精製したシログチLMMの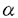 らせん含量を調べるため、測定試料を0.6MKCl、5mM MgCl2、および1mM dithiothreitolを含む50mM Tris-HCl(pH8.0)に対して透析後、JASCOJ-720W円二色性分散計を用いて円二色性スペクトルを測定した。その結果、シログチLMMの20℃における らせん含量を調べるため、測定試料を0.6MKCl、5mM MgCl2、および1mM dithiothreitolを含む50mM Tris-HCl(pH8.0)に対して透析後、JASCOJ-720W円二色性分散計を用いて円二色性スペクトルを測定した。その結果、シログチLMMの20℃における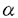 らせん含量は87.6%と算定され、既報の他生物種LMMの80-90%とほぼ同様の値を示した。 らせん含量は87.6%と算定され、既報の他生物種LMMの80-90%とほぼ同様の値を示した。 次に、シログチLMM標品を加熱しながら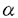 らせん含量の変化を調べたところ、28℃付近から減少し始め、41℃付近ではほぼ完全に消失していることが明らかとなった。なお、単位上昇温度あたりの らせん含量の変化を調べたところ、28℃付近から減少し始め、41℃付近ではほぼ完全に消失していることが明らかとなった。なお、単位上昇温度あたりの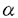 らせん含量の変化率を調べたところ、33℃付近に1つの大きなピークがみられ、温度上昇に伴うに変性が一段階の反応で生ずることが示された。 らせん含量の変化率を調べたところ、33℃付近に1つの大きなピークがみられ、温度上昇に伴うに変性が一段階の反応で生ずることが示された。 以上、本研究により、シログチ普通筋ミオシン重鎖の全一次構造が決定された。S1重鎖、S2、およびLMM各サブフラグメントの構造特性を他生物種のものと比較したところ、いずれもよく類似するものの多少の相違も認められた。さらに、大腸菌の発現系を用いてLMMを調製し、その熱力学的性状を解析したところ、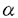 らせんの崩壊が33℃付近で急激に生ずることが明らかとなった。このように、本研究は水産食品加工上の有用魚種であるシログチにつき、普通筋ミオシンの構造や熱安定性を分子レベルから明らかにしたもので、比較生化学および食品化学上に資するところが大きいものと考えられる。 らせんの崩壊が33℃付近で急激に生ずることが明らかとなった。このように、本研究は水産食品加工上の有用魚種であるシログチにつき、普通筋ミオシンの構造や熱安定性を分子レベルから明らかにしたもので、比較生化学および食品化学上に資するところが大きいものと考えられる。 |