ペニシリン等の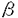 -ラクタム剤は -ラクタム剤は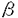 -ラクタム環をもつ抗生物質で、細菌の細胞壁の合成を阻害する。近年薬剤耐性菌の出現により、 -ラクタム環をもつ抗生物質で、細菌の細胞壁の合成を阻害する。近年薬剤耐性菌の出現により、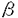 -ラクタム剤と細菌との相互作用が問題となり、細菌の持つペニシリン関連酵素の一層の研究が社会的に要請されている。ペニシリンを分解する -ラクタム剤と細菌との相互作用が問題となり、細菌の持つペニシリン関連酵素の一層の研究が社会的に要請されている。ペニシリンを分解する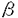 -ラクタマーゼやその標的であるペニシリン結合蛋白質(PBPと略称)は、一次構造上の相同性は低いが、二次構造の空間的配置が似ており、活性部位に保存領域が存在し、活性中心にセリンを持ち、アシル酵素機構で触媒反応を行う。本研究は、ペニシリン関連酵素である大腸菌のPBP2(高分子量PBP)と、基質特異性拡張型クラスA -ラクタマーゼやその標的であるペニシリン結合蛋白質(PBPと略称)は、一次構造上の相同性は低いが、二次構造の空間的配置が似ており、活性部位に保存領域が存在し、活性中心にセリンを持ち、アシル酵素機構で触媒反応を行う。本研究は、ペニシリン関連酵素である大腸菌のPBP2(高分子量PBP)と、基質特異性拡張型クラスA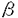 -ラクタマーゼ(ESBL)Toho-1を用いて、変異型酵素の解析やX線結晶構造解析により、それらの基質認識機構を調べたもので、三章よりなる。 -ラクタマーゼ(ESBL)Toho-1を用いて、変異型酵素の解析やX線結晶構造解析により、それらの基質認識機構を調べたもので、三章よりなる。 第一章では、PBP2の保存配列SXN領域の各残基の役割を調べている。PBP2で活性中心と考えられる387-SAD-389の領域の置換変異型酵素を作製した。変異型酵素の性質は、ペニシリン結合活性と、PBP2温度感受性変異株に対する遺伝的相補性で調べた。S387の変異型酵素はペニシリン結合活性を失っており、S387がアシル化段階で働くことが解った。A388は活性に関与していないことが解った。D389の変異型酵素はペニシリン結合活性は保持していたが、遺伝的相補性は失っていた。更にD389の変異型酵素について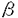 -ラクタム剤との親和性も測定した。D389を他の大腸菌PBPと同じNにしたD389Nでは、PBP2以外のPBPと同様に、メシリナムに対しては低い、セフェム系 -ラクタム剤との親和性も測定した。D389を他の大腸菌PBPと同じNにしたD389Nでは、PBP2以外のPBPと同様に、メシリナムに対しては低い、セフェム系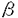 -ラクタム剤に対しては高い親和性を示し、D389が、 -ラクタム剤に対しては高い親和性を示し、D389が、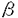 -ラクタム剤に対する特異性を決定する残基であることが解った。この結果、D389がPBP2の基質認識に関与していることが示唆され、D389の変異型酵素で相補性が失われたのは、トランスペプチダーゼの基質を認識できなかったためと解せられた。 -ラクタム剤に対する特異性を決定する残基であることが解った。この結果、D389がPBP2の基質認識に関与していることが示唆され、D389の変異型酵素で相補性が失われたのは、トランスペプチダーゼの基質を認識できなかったためと解せられた。 第2章では、立体構造解析のためのPBP2の水可溶型酵素の作製について述べている。PBP2はペリプラズムで働くが、そのN末端部分で、内膜を貫通しており可溶化が難しかった。そこでPBP2のペリプラズムに存在すると予想された領域のN末端に、マルトース結合蛋白(MBP)、チオレドキシン、Histag等を融合させた蛋白質を作製した。各融合蛋白質を大腸菌で発現さると、不溶性画分に回収されたが、MBP-PBP2では菌体懸濁時の緩衝液のpHと塩濃度を上げたり,GroELSと共発現させると、ペニシリン結合活性を保持したまま可溶性画分に多く回収された。可溶性画分に回収された蛋白質をアフィニティーカラムで精製すると、ほぼ100%の純度で精製できた。その溶解度30mg/mlであり、PBP2を高純度で、結晶化に十分な溶解度で精製することに成功した。得られたMBP-PBP2溶液の動的光散乱の測定を行ったところ、multimodalとなり、結晶化は成功していない。 第3章では大腸菌のESBLであるToho-1と第三世代セフェム系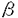 -ラクタム剤セフォタキシム(CTX)とのアシル中間体のX線結晶構造解析について述べている。Toho-1のnative構造は当研究室で解かれているが、基質特異性拡張機構の解明のため、アシル中間体のX線結晶構造解析を行った。これには脱アシル化反応に関与するE166をAに置換した酵素を用いた。精製酵素を2.1M硫安をリザーバー液に用いて結晶化した。この結晶に、CTXをソーキングしてアシル中間体を生成させた。解析の結果、分解能1.8Å、結晶学的R値18.1%、Rfree値22.9%の構造を得た。第三世代セフェム系 -ラクタム剤セフォタキシム(CTX)とのアシル中間体のX線結晶構造解析について述べている。Toho-1のnative構造は当研究室で解かれているが、基質特異性拡張機構の解明のため、アシル中間体のX線結晶構造解析を行った。これには脱アシル化反応に関与するE166をAに置換した酵素を用いた。精製酵素を2.1M硫安をリザーバー液に用いて結晶化した。この結晶に、CTXをソーキングしてアシル中間体を生成させた。解析の結果、分解能1.8Å、結晶学的R値18.1%、Rfree値22.9%の構造を得た。第三世代セフェム系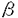 -ラクタム剤とのアシル中間体の構造解析は、本研究が初めてのものである。この構造とnative構造を比較したところ、新たにS237の側鎖と基質のカルボキシル基、N104の側鎖と基質のカルボニル基、I167の主鎖と基質のアミノ基の間に水素結合が生じていた。S237AのCTXへの活性は低下していた。更に、S237AとCTXのアシル中間体構造では、野生型と比べ基質全体の位置が移動していた。このことからS237は、基質の四員環のカルボニル基の位置を、活性中心のS70に対して適切な位置に固定する役割を担っていることが解った。また、第一世代セフェム系 -ラクタム剤とのアシル中間体の構造解析は、本研究が初めてのものである。この構造とnative構造を比較したところ、新たにS237の側鎖と基質のカルボキシル基、N104の側鎖と基質のカルボニル基、I167の主鎖と基質のアミノ基の間に水素結合が生じていた。S237AのCTXへの活性は低下していた。更に、S237AとCTXのアシル中間体構造では、野生型と比べ基質全体の位置が移動していた。このことからS237は、基質の四員環のカルボニル基の位置を、活性中心のS70に対して適切な位置に固定する役割を担っていることが解った。また、第一世代セフェム系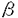 -ラクタム剤セファロチンとのアシル中間体構造と比較すると、CTXとのアシル中間体構造では, -ラクタム剤セファロチンとのアシル中間体構造と比較すると、CTXとのアシル中間体構造では, ループが動いて基質結合部位が広がり、基質が入りやすくなっていることが示唆された。 ループが動いて基質結合部位が広がり、基質が入りやすくなっていることが示唆された。 以上のように本論文は、PBPに関しては、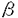 -ラクタム剤との親和性を決定する残基を特定し、水可溶型酵素の大量発現系を確立した。また、ESBLのアシル中間体構造の解析により、基質特異性拡張に関与している残基とその役割を明らかにした。これらの知見は、広がりつつある耐性菌への対策に、有益なものと思われる。よって、審査委員一同は、本論文が博士(農学)の学位論文として価値のあるものと認めた。 -ラクタム剤との親和性を決定する残基を特定し、水可溶型酵素の大量発現系を確立した。また、ESBLのアシル中間体構造の解析により、基質特異性拡張に関与している残基とその役割を明らかにした。これらの知見は、広がりつつある耐性菌への対策に、有益なものと思われる。よって、審査委員一同は、本論文が博士(農学)の学位論文として価値のあるものと認めた。 |