本研究はcPLA2欠損マウスの骨髄由来マスト細胞(BMMC)を用いてマスト細胞の脱顆粒におけるcPLA2の役割について解析を行ったものであり、下記の結果を得ている。 1.野生型およびcPLA2欠損マウス由来細胞を染色し、光学顕微鏡により観察したところコンドロイチン硫酸を多く含有するマスト細胞様の特徴を示した。また電子顕微鏡によりcPLA2欠損マウス由来細胞は形態学的に野生型と差がないことが観察された。BMMC表面に発現しているレセプター数をFACSを用いて解析したところ、Fc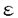 -RIおよびc-KITの発現は野生型およびcPLA2欠損マウス由来細胞の両者で差はみられなかった。以上の結果は培養した細胞はBMMCへと正常に分化しており、cPLA2がマスト細胞の分化には必須ではないことを示唆していると考えられる。 -RIおよびc-KITの発現は野生型およびcPLA2欠損マウス由来細胞の両者で差はみられなかった。以上の結果は培養した細胞はBMMCへと正常に分化しており、cPLA2がマスト細胞の分化には必須ではないことを示唆していると考えられる。 2.cPLA2欠損マウス由来BMMCにおいてアラキドン酸の遊離量、PGD2およびcys-LT産生量はいずれも検出限界レベルにまで減少していた。PAF産生では有意な低下は見られなかったものの、cPLA2欠損マウス由来BMMCにおいて減少する傾向にあり、cPLA2がPAF産生に部分的に関与していることが示唆された。以上のことから、抗原刺激後の即時相では、cPLA2が生理活性脂質産生において主要な働きをしていることがわかった。 3.ヒスタミン放出量は野生型およびcPLA2欠損マウス由来BMMCとも抗原刺激後約2分で最大値に達したが、cPLA2欠損マウス由来BMMCでは野生型に比べ有意に低下していた。また細胞内のヒスタミン含量はcPLA2欠損マウス由来BMMCでは1513±60.32ng/106 cellsと野生型2602±189.2ng/106 cellsに比べ約40%の減少がみられた。その結果、正味のヒスタミン放出の割合は野生型に対しcPLA2欠損マウス由来BMMCで有意に上昇していた。 ヒスタミン合成酵素であるヒスチジンデかルボキシラーゼ(HDC)のmRNAのノーザンブロッティングにより、野生型およびcPLA2欠損マウス由来BMMCの両者に差は見られないことがわかった。しかし、抗HDC抗体を用いた免疫沈降法によりcPLA2欠損マウス由来BMMCのHDCタンパク質はほとんど発現しておらず、cPLA2欠損マウス由来BMMCにおいてはHDCタンパク質の安定性もしくは転写の段階において何らかの問題が生じていると考えられた。またこのことはcPLA2欠損マウス由来BMMCにおいてヒスタミン含有量が低下している結果と一致した。 4.脱顆粒反応の指標として用いられている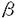 -ヘキソサミニダーゼ( -ヘキソサミニダーゼ(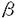 -HEX)の抗原刺激後の放出割合を測定したところ、HDCの場合と同じくcPLA2欠損マウス由来BMMCにおいて野生型に比べ抗原濃度依存的また時間依存的に有意に亢進していた。 -HEX)の抗原刺激後の放出割合を測定したところ、HDCの場合と同じくcPLA2欠損マウス由来BMMCにおいて野生型に比べ抗原濃度依存的また時間依存的に有意に亢進していた。 5.抗原刺激による細胞内カルシウム濃度の上昇はcPLA2欠損マウス由来BMMCで野生型に比べ有意に上昇しており、また細胞内カルシウム濃度がピークに達する時間はcPLA2欠損マウス由來BMMCでは野生型より長かった。脱顆粒にはカルシウムの濃度上昇が必須とされていることから、おそらくcPLA2欠損マウス由来BMMCではカルシウム濃度の上昇が野生型よりも高いため、脱顆粒が亢進しているものと思われる。 以上、本論文はcPLA2欠損マウス由来BMMCを用いた解析からcPLA2欠損マウスのアナフィラキシー反応の減弱はマスト細胞における炎症性メディエーターの低下によることを明らかにした。また予想に反し、BMMCの脱顆粒反応はcPLA2欠損マウスにおいて野生型に比べ亢進していることから、アラキドン酸およびアラキドン酸代謝物、もしくはcPLA2それ自体が脱顆粒反応を調節している可能性を示唆すると考えられる。本研究はこれまで別々に考えられていた、抗原刺激後のマスト細胞の生理活性脂質産生と脱顆粒反応がなんらかの相互作用をしており、cPLA2阻害薬を開発する際の副作用を考える上で有益な情報をもたらし、IgEレセプーター以降のシグナル伝達の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |