本研究は、炎症反応の亢進に深く関っていると考えられる生理活性脂質のロイコトリエンB4(LTB4)の作用機序を知るために、LTB4感受性が高いモルモットのLTB4受容体(BLT)の構造と機能の解析を試みたものである。下記の結果を得ている。 1.既に単離されているヒトBLT cDNAのORFをプローブにして、モルモット白血球cDNAライブラリーをスクリーニングし、全長のORFを含むモルモットBLT cDNAを単離した。モルモットBLTは、348アミノ酸残基からなり、7回膜貫通型受容体の構造をとると推定された。ヒトBLTとのアミノ酸同一性は、全体で73%であり、第2、第3、第7膜貫通ドメインおよび第2、第3細胞内ループでとくに高い相同性を示した。BLTの一次構造はIL-8受容体やfMLP受容体の一次構造に最も類似しているが、アミノ酸の同一性は30%ほどであり、独立した受容体ファミリーを形成する可能性が示唆された。 2.モルモットBLTの臓器分布について、ノーザンブロッティングによる解析を行った結果、モルモットBLTのmRNAは白血球で強い発現が、肺や脾臓で弱い発現が認められた。今回の結果は、これまでLTB4結合能が報告されている組織と一致しており、LTB4の標的組織であると考えられた。 3.モルモットBLTのcDNAを導入したHEK293細胞の膜画分に対して、[3H]LTB4結合は解離定数0.27nMを示した。さらに、モルモットBLT cRNAを微量注入したアフリカツメガエルの卵母細胞において、LTB4刺激による膜電流変化が観察されたことから、今回クローニングした遺伝子がLTB4に高親和性であり、LTB4刺激に対して機能する受容体であることが明かとなった。 4.モルモットBLT cDNAを導入したHEK293細胞の膜画分における[3H]LTB4結合は、LTB4およびLTB4代謝産物である20-hydroxy-LTB4によって同程度に阻害され、さらに12-keto-LTB4、20-carboxy-LTB4、6-trans-LTB4、6-trans-12-epi-LTB4、12(R)-HETEの順に阻害された。また、モルモット白血球の膜画分、およびヒトBLTを一過性に発現させたHEK293細胞膜画分においても同様の結果が得られたことから、BLTに対するLTB4および20-hydroxy-LTB4の結合活性が同等であることが示唆されるとともに、LTB4の不活性化において20-hydroxy-LTB4から20-carboxy-LTB4へと進む酸化反応の速度が重要であると推察された。 5.モルモットBLTを定常発現させたCHO細胞において、LTB4はフォルスコリン刺激によって活性化されたアデニル酸シクラーゼ活性を濃度依存的に阻害した。また20-hydroxy-LTB4も同等の阻害効果を示したことから、LTB4および20-hydroxy-LTB4はモルモットBLTを介してGi様のG蛋白質を同程度に活性化することが明かとなった。また、同細胞における細胞内カルシウムの上昇作用について解析した結果、20-hydroxy-LTB4刺激による細胞内カルシウム濃度変化はLTB4刺激時よりも弱い上昇を示した。細胞内カルシウムの濃度上昇はPTX処理によって部分的にしか抑制されないことから、BLTはGq様Gタンパク質の活性化にも働くと考えられた。また、20-hydroxy-LTB4はGq様Gタンパク質の活性化において部分活性を示すと考えられた。 6.モルモットBLTを発現させたCHO細胞は、1から10nM濃度のLTB4に対して遊走活性が最大になり、さらに高濃度では遊走活性が抑制されるという、ベル型の反応曲線を示した。20-hydroxy-LTB4および20-carboxy-LTB4に対する遊走はそれぞれ1から10nM、1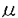 Mで最大になるが、いずれもLTB4に対する遊走よりも低い活性を示した。LTB4に対するBLTを介した細胞遊走は、Gi様Gタンパク質の活性化が必要であることが報告されている。しかし今回の結果から、Gi様のGタンパク質以外の細胞内シグナル伝達分子がBLTの作用に関与すると推察され、LTB4および20-hydroxy-LTB4による細胞遊走活性の差異が生じるものと考えられた。 Mで最大になるが、いずれもLTB4に対する遊走よりも低い活性を示した。LTB4に対するBLTを介した細胞遊走は、Gi様Gタンパク質の活性化が必要であることが報告されている。しかし今回の結果から、Gi様のGタンパク質以外の細胞内シグナル伝達分子がBLTの作用に関与すると推察され、LTB4および20-hydroxy-LTB4による細胞遊走活性の差異が生じるものと考えられた。 以上、本論文はモルモットBLTのcDNAの単離および機能解析により、モルモットBLTの一次構造を明らかにするとともに、LTB4およびその代謝産物である20-hydroxy-LTB4による受容体活性化における差異を明らかにした。本研究は、BLTを介するLTB4の作用機序の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |