本研究は、細菌感染やシクロヘキシミド投与によってICRマウス消化管に誘導される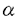 1,2フコース転移酵素の酵素的性質を明らかにし、その遺伝子をクローニングするとともに、生成物フコシルGM1とフコシルアシアロGM1(フコシルGA1)について、生化学的、免疫化学的手法によって解析を行い、以下の結果を得ている。 1,2フコース転移酵素の酵素的性質を明らかにし、その遺伝子をクローニングするとともに、生成物フコシルGM1とフコシルアシアロGM1(フコシルGA1)について、生化学的、免疫化学的手法によって解析を行い、以下の結果を得ている。 1.二種類のフコース含有糖脂質フコシルGA1(IgMとIgG2)と、フコシルGM1(IgG3)に対する特異的なモノクローナル抗体を作成し、0.5ng以上の抗原糖脂質の定量を可能にした。 2.無菌マウス消化管のGA1、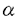 1,2フコース転移酵素活性を調べた結果,胃、盲腸および結腸には高い活性が検出されるが、小腸には検出されなかった。しかし、シクロヘキシミドを投与すると、12時間後に十二指腸、空腸、回腸に強いGA1、 1,2フコース転移酵素活性を調べた結果,胃、盲腸および結腸には高い活性が検出されるが、小腸には検出されなかった。しかし、シクロヘキシミドを投与すると、12時間後に十二指腸、空腸、回腸に強いGA1、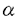 1,2フコース転移酵素活性が誘導された。無菌マウスの状態で活性を持つ胃、盲腸および結腸では、シクロヘキシミド投与後も活性はほとんど変化しなかった。 1,2フコース転移酵素活性が誘導された。無菌マウスの状態で活性を持つ胃、盲腸および結腸では、シクロヘキシミド投与後も活性はほとんど変化しなかった。 3.無菌マウスの状態で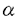 1,2フコース転移酵素活性を持つ胃、盲腸および結腸には、フコシルGA1とフコシルGM1のいずれも含まれるが、シクロヘキシミド投与によって活性が誘導される十二指腸、空腸、回腸では、フコシルGA1のみが合成された。これはこれらの部分に基質GA1がGM1よりも80倍高い濃度で含有されていることが原因であることを示した。 1,2フコース転移酵素活性を持つ胃、盲腸および結腸には、フコシルGA1とフコシルGM1のいずれも含まれるが、シクロヘキシミド投与によって活性が誘導される十二指腸、空腸、回腸では、フコシルGA1のみが合成された。これはこれらの部分に基質GA1がGM1よりも80倍高い濃度で含有されていることが原因であることを示した。 4.モノクローナル抗体を用いた免疫組織染色の結果、シクロヘキシミドで誘導されたフコシルGA1は、十二指腸絨毛上1/2に限定して分布しており、また、発現部位は上皮細胞であった。特定の分化段階にある上皮細胞においてフコシルGA1が誘導されると思われる。 5.RT-PCR法により、通常飼育マウス小腸cDNAから三種類の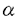 1,2フコース転移酵素の遺伝子(MFUT-I、MFUT-IIおよびMFUT-III)を単離した。MFUT-IIは、初めてクローニングされた遺伝子であった。 1,2フコース転移酵素の遺伝子(MFUT-I、MFUT-IIおよびMFUT-III)を単離した。MFUT-IIは、初めてクローニングされた遺伝子であった。 6.Northernブロッテイング法により、MFUT-II遺伝子はICRマウスの消化管、心、肝、腎および生殖器に、MFUT-I、MFUT-II遺伝子はそれぞれ精巣上体、精巣にのみ発現していた。 7.NorthernブロッテイングとRT-PCR法により、シクロヘキシミドによるマウス小腸における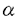 1,2フコース転移酵素活性の誘導は、MFUT-IIのmRNA量の増加に依存していることが示された。 1,2フコース転移酵素活性の誘導は、MFUT-IIのmRNA量の増加に依存していることが示された。 8.COS-7細胞を用いて一過性に発現させた酵素について、その性質を調べると、水溶性基質に対する活性はMFUT-IとMFUT-II酵素は持っているが、MFUT-III酵素は持っていないことが分かった。また、MFUT-I酵素はGA1に対する親和性がとりわけ強く、MFUT-II酵素はGA1、GM1、ラクト系列糖脂質に対してもフコースを転移する活性を持っていることが示された。 9.マウスのMFUT-I、MFUT-IIおよびMFUT-III遺伝子は、それぞれ、ヒトのII、SeおよびSec1遺伝子と相同性が高い配列を持っていた。 以上、本論文は、無菌マウスの消化管にシクロヘキシミド投与によって誘導される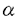 1,2フコース転移酵素遺伝子をクローニングし、COS-7細胞に一過性に発現させ、その酵素学的性質を明らかにした。また、生成物に対するモノクローナル抗体を独自に樹立し、誘導される部位についての解析も行っており、消化管における糖鎖の役割の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 1,2フコース転移酵素遺伝子をクローニングし、COS-7細胞に一過性に発現させ、その酵素学的性質を明らかにした。また、生成物に対するモノクローナル抗体を独自に樹立し、誘導される部位についての解析も行っており、消化管における糖鎖の役割の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |