癌抑制遺伝子WT1はウィルムス腫瘍の原因遺伝子で、ウィルムス腫瘍の10-15%程度のケースでWT1遺伝子の変異が見られるほか、腎臓や生殖巣の形成異常を伴う合併疾患において高頻度に変異が見られる。その遺伝子産物は4つのZnフィンガーを介してGCに富む配列に結合し、様々な遺伝子の転写を制御すると考えられている。CATアッセイやルシフェラーゼアッセイによりWT1が成長因子やそのレセプター遺伝子の転写を抑制することが報告されているが、内在性の遺伝子の発現が抑制される例は確認されていない。むしろディファレンシャルディスプレイ法やDNAマイクロアレイ法などでの解析により、WT1は転写活性化因子としてp21やbcl-2などの遺伝子の転写を促進して細胞周期の進行停止やアポトーシスの阻害にはたらくと考えられつつある。個体レベルで見るとWT1の発現は限局しており、胎児期の腎臓、生殖巣、成体の腎臓、脾臓、卵巣の濾胞細胞、精巣のセルトリ細胞などに発現している。また、ノックアウトマウスの解析により、腎臓、生殖巣、脾臓の形成に必要であることが示されている。最近、WT1遺伝子の白血病細胞での異常発現が報告され、腎臓などの細胞ではWT1は増殖を抑制するのに対して白血病細胞ではむしろ細胞の増殖に必要とされていることが明らかになった。 このWT1の異なる細胞における細胞増殖に対する効果の違いはどのように制御されているのであろうか。私はWT1が腎臓の細胞と血球系の細胞とで異なる因子と結合して転写制御能の調節を受け、細胞増殖を正や負に制御している可能性を考えた。WT1と結合する因子はすでにいくつか報告されていたが、いずれも白血病細胞でのWT1の細胞増殖に対する必要性を説明できるものではなかった。そこで白血病細胞におけるWT1の機能制御を調べることを目的に、two-hybrid法を用いてWT1と結合する因子の単離を試みた。WT1が発現しており、その増殖にWT1を必要とすることが分かっているCML-BC由来細胞株であるK562細胞のcDNAライブラリーをWT1(+/+)の全長をbaitに用いてスクリーニングした。1.6x107個のクローンをスクリーニングした結果、467個のポジティブクローンが得られた。そのうち、263個はすでにWT1と結合することが報告されているユビキチン結合酵素hUBC9であった。残り204個のうち51個はCys4タイプのZnフィンガーを持つ転写因子をコードする新規遺伝子であった。その他にGATA-1を始めとする幾つかの既知の転写因子や転写因子様のタンパク質をコードする新規遺伝子が単離された。これまではWT1に血球系細胞特異的な何らかの因子が結合してWT1の機能を制御するモデルを考えていたが、この結果から、WT1が他の転写因子に結合してその転写因子の機能を制御する可能性を考えた。なかでも、GATA-1はその発現が、赤血球、巨核球、マスト細胞などの血球系の細胞に限られており、赤血球や巨核球の分化に必須である。また、急性骨髄性白血病(AML)においてWT1との共発現が見られることなどから、WT1がGATA-1に結合してその機能に影響を与えることで、細胞の分化を阻害して白血病の発症や維持に関与しているのではないかと考え、研究を進めた。 まず、GST-pull down法と免疫共沈降法によりWT1とGATA-1とがin vitroおよびin vivoで結合することを明らかにした。次に、WT1とGATA-1との結合に必要な領域を検討した。その結果、WT1とGATA-1の両者のZnフィンガーを介することが明らかとなった。この結合がGATA-1の機能にどのような影響を与えるかを調べるため、GATA-1の転写活性化能に対するWT1の効果をルシフェラーゼアッセイにて検討した。その結果、GATA-1依存的な転写活性化に対して、WT1は協調的に作用してさらに転写を活性化することがわかった。GATA-1による転写活性化に対して協調的に働くからといって単純にGATA-1による細胞分化を促進すると結論することは出来ない。例えば、GATA-1のコファクターであるFOG-1はGATA-1による赤血球や巨核球への分化誘導を促進するが、標的遺伝子によってFOG-1はGATA-1による転写活性化を促進する場合もあれば抑制する場合もある。FOG-1の他にもCBPもGATA-1による赤血球への分化を促進するコファクターとして機能することが知られており、GATA-1による細胞分化の誘導には、GATA-1とそのコファクターとによってGATA-1の標的遺伝子の転写の活性化や抑制が厳密に制御されることが必要であると考えられている。 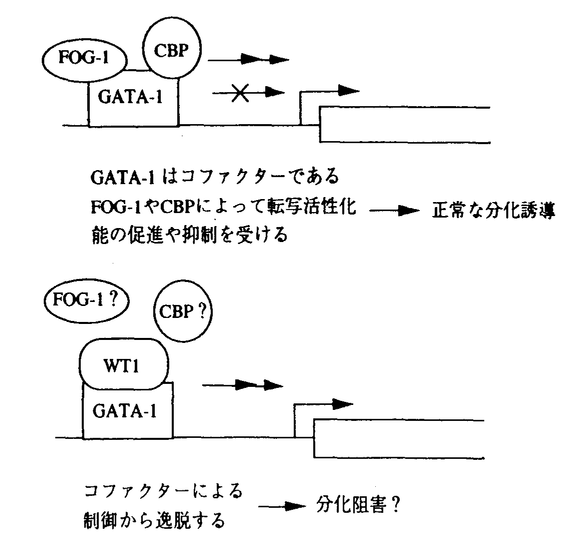 図表 図表 本研究で用いたレポーターではFOG-1はGATA-1による転写活性化を抑制することが報告されている。そこで、ルシフェラーゼアッセイによってGATA-1の転写活性化のFOG-1による抑制に対して、WT1がどのような影響を及ぼすかを検討した。その結果、FOG-1はGATA-1による転写活性化を抑制したが、WT1はFOG-1による抑制効果を阻害し、GATA-1による転写活性化を回復させた。すなわち、WT1はGATA-1による転写活性化に対して協調的に働くだけでなく、GATA-1の転写制御に対するFOG-1の機能に対して競合的に作用することが示された。以上のことから、WT1はGATA-1の転写活性化能の補助因子による厳密な制御を逸脱させることで細胞分化を阻害し、白血病細胞の発症、維持に関与している可能性が示唆された。 今後、GATA-1の赤血球への分化誘導能に対するWT1の効果をin vivoで検討する必要がある。また、FOG-1とGATA-1とによって制御されるGATA-1の標的遺伝子、WT1による協調的作用を受けるGATA-1の標的遺伝子の同定が進めば、WT1の働きがより明らかになってくると思われる。さらに、本研究ではWT1とGATA-2との結合も示しており、両者の発現している造血幹細胞や骨髄性白血病細胞でのWT1の役割を知るうえでもこの知見は重要であると思われる。 |