機能的な高親和性GM-CSFレセプター(GMR)は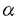 鎖 鎖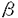 鎖( 鎖(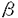 c)の二本鎖から構成され、 c)の二本鎖から構成され、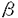 鎖はIL-3、IL-5と共有される。細胞内部分の欠失変異体を用いて 鎖はIL-3、IL-5と共有される。細胞内部分の欠失変異体を用いて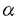 鎖、 鎖、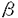 c両者の細胞内部分がシグナル伝達に必須であることが示された。一方でキメラレセプターを用いた解析から c両者の細胞内部分がシグナル伝達に必須であることが示された。一方でキメラレセプターを用いた解析から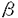 鎖の細胞内部分のオリゴマーのみでも初期応答遺伝子の活性化、細胞増殖などを誘導しうることが明らかであり、両鎖のシグナル伝達に果たす役割には未知の部分が多い。私の所属する研究グループでは主に 鎖の細胞内部分のオリゴマーのみでも初期応答遺伝子の活性化、細胞増殖などを誘導しうることが明らかであり、両鎖のシグナル伝達に果たす役割には未知の部分が多い。私の所属する研究グループでは主に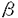 cに焦点をあわせ種々の細胞での、野生型、欠失変異体、点変異体を用いた再構成実験を行ないGM-CSFレセプターのシグナル伝達の解析を進めてきた。種々の cに焦点をあわせ種々の細胞での、野生型、欠失変異体、点変異体を用いた再構成実験を行ないGM-CSFレセプターのシグナル伝達の解析を進めてきた。種々の cの変異体を用いた実験により、GM-CSFのシグナルは2つに大別されることが明らかになった。第一は、細胞膜貫通直下の領域(box1)のみを必要とするc-myc活性化、DNA合成開始活性化に連結する伝達経路である。この経路に関与するシグナル伝達分子についてはチロシンキナーゼ阻害剤Genistein感受性の分子が関与していることが明らかである他は未知の部分が多い。第二のシグナル伝達経路は細胞膜直下の部分に加えてより細胞内部分の領域も必要とする。この経路はShc,SHP2などのSH2蛋白の活性化と続くMAPキナーゼカスケードをへてc-fos,c-junの活性化に至る。この領域は複数のチロシン残基を含むことから、増殖因子型レセプター同様にリン酸化されたチロシン残基をSH2蛋白質が認識して会合し活性化に至るとことが明らかになった。また、以上の全てのシグナル伝達にはbox1領域が必須であり、これはチロシンキナーゼJAK2を介したものであることが示された。 cの変異体を用いた実験により、GM-CSFのシグナルは2つに大別されることが明らかになった。第一は、細胞膜貫通直下の領域(box1)のみを必要とするc-myc活性化、DNA合成開始活性化に連結する伝達経路である。この経路に関与するシグナル伝達分子についてはチロシンキナーゼ阻害剤Genistein感受性の分子が関与していることが明らかである他は未知の部分が多い。第二のシグナル伝達経路は細胞膜直下の部分に加えてより細胞内部分の領域も必要とする。この経路はShc,SHP2などのSH2蛋白の活性化と続くMAPキナーゼカスケードをへてc-fos,c-junの活性化に至る。この領域は複数のチロシン残基を含むことから、増殖因子型レセプター同様にリン酸化されたチロシン残基をSH2蛋白質が認識して会合し活性化に至るとことが明らかになった。また、以上の全てのシグナル伝達にはbox1領域が必須であり、これはチロシンキナーゼJAK2を介したものであることが示された。 私たちが解析に用いている培餐細胞株BA/F3細胞はマウスの血球細胞でその増殖と生存にマウIL-3の存在が必須である。この細胞にヒトGM-CSFレセプターを再構成するとこの細胞でシグナルを伝えうること、特にその増殖と生存を維持することを利用して様々な解析を加えてきた。私は細胞の生存に興味を持ち染色体DNAの断片化、caspase-3の活性化などを指標にしてBA/F3細胞のアポプトーシスについて検討を加えた。BA/F3細胞はマウスIL-3の除去によって速やかに細胞死に至る。また、このときガンマ線を照射すると細胞死はさらに速いタイムコースで起こる事を明らかにした。さらにこの際ヒトGM-CSPの添加によってサイトカイン除去によるアポプトーシス、ガンマ線によるアポプトーシスの両者とも抑制されることを明らかにした。そこで、私はこのときどのようなシグナルが必要なのか、さまざまなレセプター変異体、薬剤を用いて明らかにすることを研究テーマとした。 まずはじめにBA/F3細胞にヒトGM-CSFレセプターの様々な変異体を導入しGM-CSFによるBA/F3細胞の生存に必要なレセプター領域を決定した。BA/F3細胞の生存にはレセプター 鎖box1領域が必須であるがC末端側に存在するチロシン残基は必要でないことを明らかにした。これらのチロシン残基を介してMAPKカスケードが活性化されることから、GM-CSFによるBA/F3細胞の生存にはMAPKカスケードの活性化は必要ではないことが明らかになった。また、ガンマ線照射に誘導されるアポプトーシスについて検討を加えると、やはり同様にbox1領域のみが必要であることが明らかになった。 鎖box1領域が必須であるがC末端側に存在するチロシン残基は必要でないことを明らかにした。これらのチロシン残基を介してMAPKカスケードが活性化されることから、GM-CSFによるBA/F3細胞の生存にはMAPKカスケードの活性化は必要ではないことが明らかになった。また、ガンマ線照射に誘導されるアポプトーシスについて検討を加えると、やはり同様にbox1領域のみが必要であることが明らかになった。 次に種々の薬剤の影響について検討を加えた。Box1領域がJAK2の活性化に必須であるということが明らかであるので、box1の抗アポプトーシスへの役割がJAK2を介したものであるかどうかを検討するため、JAK特異的阻害剤として知られるAG490の影響を検討した。アポプトーシスによって誘導される染色体DNAの断片化を指標にAG490の影響を検討すると、BA/F3細胞はGM-CSFが存在していてもAG490が共存するとアポプトーシスにおちいること、また、ガンマ線照射によって誘導されるアポプトーシスについても同様の結果を得た。従ってJAK2が必須の役割を果たしていることが示唆された。我々はこれまでチロシンキナーゼ阻害剤として知られるGenisteinがGM-CSFによる細胞増殖とc-myc遺伝子の活性化を阻害するがMAPKカスケード、c-fos遺伝子の活性化はむしろ昂進することを明らかにしている。一方MEK1阻害剤であるPD98059は増殖に影響しないがMAPKカスケード、c-fos遺伝子の活性化は完全に阻害する。これらの阻害剤は、それぞれ単独の添加ではGM-CSFによる細胞生存に影響しないが、両者を同時に加えるともはや細胞は生存できずアポプトーシスに陥ることが明らかになった。従ってGenistein感受性のシグナル伝達経路あるいはMAPKカスケードのどちらかが活性化されればアポプトーシスは抑制されることが予測された。 さらにPI3K、AKT経路の関与について検討を行った。PI3K、AKTは細胞の生存に関与していることがほかのグループによって示唆されている。PI3KはBA/F3細胞においてGM-CSFにより活性化される事が明らかであったが、AKTについては不明であった。そこで私はまずBA/F3細胞におけるAKTの活性化について検討を加えた。AKTの活性化は野生型hGM-CSFレセプターを介して約5分後に活性化されるが、Fallでは活性化されなかったことから細胞内チロシン残基の役割が示唆された。また、このAKT活性化はPI3Kの阻害剤であるWortmanninによって阻害され、AKT活性化はPI3Kの下流にあることが予測された。そこで次にこのシグナル経路のGM-CSFの抗アポプトーシス活性への役割を検討するために、Wormannin、さらに同様にPI3K阻害剤として知られるLY294002の影響を検討したところ、これらの薬剤はいずれも影響がなかった。以上のことからこの経路はBA/F3細胞におけるGM-CSFによる抗アポトーシス活性には関与していないことが予測された(図1)。  図1.GM-CSFによるBA/F3細胞のアポプトーシス抑制に対する種々の薬剤の効果。BA/F-wild、BA/F-544、およびBA/F-Fall細胞の培養液中よりマウスIL-3を除去し、図に示した薬剤で処理した。これらの細胞をヒトGM-CSF存在下(GM-CSF)あるいは非存在下(-)でさらに24時間培養した後に、DNA断片化の誘導をTUNELアッセイを用いて解析した。 図1.GM-CSFによるBA/F3細胞のアポプトーシス抑制に対する種々の薬剤の効果。BA/F-wild、BA/F-544、およびBA/F-Fall細胞の培養液中よりマウスIL-3を除去し、図に示した薬剤で処理した。これらの細胞をヒトGM-CSF存在下(GM-CSF)あるいは非存在下(-)でさらに24時間培養した後に、DNA断片化の誘導をTUNELアッセイを用いて解析した。 さらに抗アポプトーシスの機構について解析するためBclファミリー蛋白の挙動についてNorthernblot解析を用いて検討を加えた。まず、bcl-2について検討したがBA/F3細胞ではbcl-2の遺伝子の活性化は見いだされなかった。そこでbcl-xLについて検討するとbcl-xL遺伝子はGM-CSFの添加によって誘導され、その活性化はGenisteinの添加によってかなり抑制されるが、PD98059,Wormanninによっては影響を受けなかった。また、Fall変異体を介してもbcl-xL遺伝子は誘導された。c-myc遺伝子も細胞の増殖、生存などとのかかわりが指摘されている。そこでc-myc遺伝子活性化についても同様に検討を加えると、c-mycはbcl-xL同様に野生型レセプターでもFallレセプターでも活性化されるが、薬剤に対する感受性はGenisteinの添加のみで完全に阻害されるなど異なっていることが明らかになった。すなわち両遺伝子は細胞生存へのかかわりが示唆されながらその制御機構は全く異なっていること、また、薬剤に対する感受性はとちらもGM-CSFの抗アポプトーシス活性の薬剤感受性とは異なっていることが明らかになった。 ガンマ線照射によるアポプトーシスの誘導の際、p53蛋白質のかかわりが指摘されている。そこで私はBA/F3細胞でのp53の挙動を検討してみるとGM-CSFの存在、非存在にかかわらずガンマ線照射によってp53蛋白質の量が増加した。この時のbax、bcl-xL遺伝子の誘導はガンマ線照射によってbax遺伝子が誘導されるが、その際bcl-xL遺伝子がGM-CSFによって誘導されるので両者の比を検討すると、GM-CSF存在下ではガンマ線照射時でも非照射時と同様の比を保っていることから、この機構が抗ガンマ線誘導アポプトーシスに役割を果たしていることが示唆された(図2)。  図2.GM-CSF存在下、非存在下での、ガンマ線照射によるp53タンパク質およびbax、bcl-XL遺伝子の発現の挙動。BA/F-wild細胞を、培養液中よりマウスIL-3を除去した後、ヒトGM-CSF(10ng/ml)含有培地(+)あるいは非含有培地(-)に再懸濁した。これらの細胞に 図2.GM-CSF存在下、非存在下での、ガンマ線照射によるp53タンパク質およびbax、bcl-XL遺伝子の発現の挙動。BA/F-wild細胞を、培養液中よりマウスIL-3を除去した後、ヒトGM-CSF(10ng/ml)含有培地(+)あるいは非含有培地(-)に再懸濁した。これらの細胞に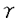 線照射(10Gy)を行ってから培養し、1時間後のものをp53の解析に、6時間後のものをbaxおよびbcl-XLの解析に使用した。A.細胞抽出液を調製し、p53タンパク質の発現量を抗p53抗体を用いたウエスタンブロットにより解析した。B.細胞よりmRNAを抽出して、bax、bcl-XL、あるいはG3PDH遺伝子のプローブを用いたノザンブロット解析を行った。C.図Bの各バンドの強さをBAS2000(富士フィルム)を用いて定量した。上段および中断には、G3PDHの値を用いて標準化したbaxおよびbcl-XLの値をそれぞれ示した。下段には、baxとbcl-XLの値(標準化したもの)の比を示した。 線照射(10Gy)を行ってから培養し、1時間後のものをp53の解析に、6時間後のものをbaxおよびbcl-XLの解析に使用した。A.細胞抽出液を調製し、p53タンパク質の発現量を抗p53抗体を用いたウエスタンブロットにより解析した。B.細胞よりmRNAを抽出して、bax、bcl-XL、あるいはG3PDH遺伝子のプローブを用いたノザンブロット解析を行った。C.図Bの各バンドの強さをBAS2000(富士フィルム)を用いて定量した。上段および中断には、G3PDHの値を用いて標準化したbaxおよびbcl-XLの値をそれぞれ示した。下段には、baxとbcl-XLの値(標準化したもの)の比を示した。 私たちの研究グループでは以前JAK2の生理活性をレセプターの活性化と切り離して検討するためDNA GyraseあるいはGM-CSFレセプタ-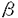 cの二量体化部分を用いてJAK2との融合蛋白質を作製し、JAK2を人為的に活性化させることに成功した。DNA Gyrase融合蛋白質は細胞質で活性化が起こり、 cの二量体化部分を用いてJAK2との融合蛋白質を作製し、JAK2を人為的に活性化させることに成功した。DNA Gyrase融合蛋白質は細胞質で活性化が起こり、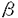 c融合蛋白質は膜近傍で活性化が起こる。そこでこれらの融合蛋白質が抗アポプトーシスにどのような活性をもつか検討した。するとDNA Gyrase-JAK2はBA/F3細胞の生存も維持できず、またガンマ線照射によるアポプトーシスもDNA Gyrase-JAK2の存在にかかわらず起こるのに対し、 c融合蛋白質は膜近傍で活性化が起こる。そこでこれらの融合蛋白質が抗アポプトーシスにどのような活性をもつか検討した。するとDNA Gyrase-JAK2はBA/F3細胞の生存も維持できず、またガンマ線照射によるアポプトーシスもDNA Gyrase-JAK2の存在にかかわらず起こるのに対し、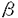 c-JAK2はBA/F3細胞の生存を維持した。しかし、ガンマ線照射時のアポプトーシスは抑制できなかった。以上のことから細胞の生存には細胞膜付近でJAK2が活性化されることが必要であること、しかしガンマ線照射によるアポプトーシスを抑制するにはさらに別のシグナル伝達経路が必要であることが明らかになった。 c-JAK2はBA/F3細胞の生存を維持した。しかし、ガンマ線照射時のアポプトーシスは抑制できなかった。以上のことから細胞の生存には細胞膜付近でJAK2が活性化されることが必要であること、しかしガンマ線照射によるアポプトーシスを抑制するにはさらに別のシグナル伝達経路が必要であることが明らかになった。 以上のように私はGM-CSF/BA/F3細胞の系を用いてその抗アポプトーシス活性のシグナル伝達について系統的に検討を加えてきた。今後はGenisteinの標的分子の同定、さらにはゼブラフィッシュなど個体の系を用いてアポプトーシスとその抑制の個体発生における意義について解析を広げていきたいと考えている。 |