小脳は他の脳内部位に比較して多くの神経細胞から成るが、細胞の種類は少ない。皮質において層状に配置された神経細胞は一様な回路を構成している。皮質の中でプルキニエ細胞が唯一の出力であり、主要な興奮性の入力は苔状線維と登上線維の2系統である。また、破壊実験等により協調運動制御や運動学習において小脳が重要な役割を担うことも報告されている。このため、小脳は早い時期から記憶・学習機構の研究に適した部位として取り上げられ、機能のモデルや理論が構築されてきた。近年になり、平行線維-プルキニエ細胞間に形成されるシナプスには記憶・学習の基礎メカニズムと考えられているシナプス可塑性(LTD,LTP)が存在することが報告され、ノックアウトマウスの解析からLTDが小脳運動学習の基礎メカニズムであることが示唆されつつある。しかし、従来の標的遺伝子組み換え法によって作成されたノックアウトマウスの示す表現型の解釈には問題点が残されている。そこで、私は小脳神経回路における記憶・学習の分子機構およびシナプス可塑性の役割を解明する目的から、脳高次機能の解析に適する部位・時期特異的遺伝子組み換え法の開発を行った。 はじめに大腸菌P1ファージ由来のCre/loxP遺伝子組み換えシステムを応用し、時期特異的に遺伝子をノックアウトする系の確立を行った。Creは34bPのloxP配列を認識して、2つのloxPに挟まれたDNA配列を欠失させる組み換え酵素である。Creに変異型のプロゲステロンレセプターホルモン結合領域を組み合わせて、活性化の制御を試みた。C末端の42アミノ酸を欠損した変異型プロゲステロンレセプターホルモン結合領域はアンチプロゲステロンをアゴニストとし、内在性のプロゲステロンに対する結合能はほとんどもたないことから生体内のCre活性のコントロールに適していると考えた。まず、培養細胞においてCrePR融合蛋白の機能を検討した。CrePR発現ベクターと、loxP間の組み換えにより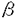 -ガラクトシダーゼを発現するレポーターベクターを作成し、NIH3T3細胞に導入してstable clonesを得た。この細胞株にアンチプロゲステロンを投与し、 -ガラクトシダーゼを発現するレポーターベクターを作成し、NIH3T3細胞に導入してstable clonesを得た。この細胞株にアンチプロゲステロンを投与し、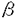 -ガラクトシダーゼ活性測定、X-gal染色を行った結果、CrePRがアンチプロゲステロン投与依存的にCre活性を発現することが示された。 -ガラクトシダーゼ活性測定、X-gal染色を行った結果、CrePRがアンチプロゲステロン投与依存的にCre活性を発現することが示された。 次に、小脳顆粒細胞選択的に発現するNMDA型GluR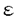 3サブユニットのプロモーター領域を用いてCrePR発現マウスの作成を行った。GluR 3サブユニットのプロモーター領域を用いてCrePR発現マウスの作成を行った。GluR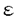 3サブユニット遺伝子のプロモーター領域を含んだ10kbのゲノムに翻訳開始コドンからCrePR遺伝子を接続し、その下流にG-CSFのpA付加シグナルをいれた発現ベクターを作成し、マウス受精卵に注入してC57BL/6の遺伝子背景をもつトランスジェニックマウスを作成した。作成したトランスジェニックマウス24系統中19系統で生殖系列伝達が確認され、小脳のmRNAをもちいたRT-PCRによりCrePR mRNAの発現量が多い2系統を分離した。さらに、この2系統のマウスの前脳および小脳のmRNAをもちいたNorthern blot解析を行ったところ、1系統(ECP25)の小脳でCrePR mRNAの高い発現が検出された。In situ hybridizationの結果、ECP25系統マウスの小脳でCrePR mRNAが顆粒細胞特異的に発現していることが確認された。しかしながら、X葉とIX葉の尾側部では発現が確認されなかった。 3サブユニット遺伝子のプロモーター領域を含んだ10kbのゲノムに翻訳開始コドンからCrePR遺伝子を接続し、その下流にG-CSFのpA付加シグナルをいれた発現ベクターを作成し、マウス受精卵に注入してC57BL/6の遺伝子背景をもつトランスジェニックマウスを作成した。作成したトランスジェニックマウス24系統中19系統で生殖系列伝達が確認され、小脳のmRNAをもちいたRT-PCRによりCrePR mRNAの発現量が多い2系統を分離した。さらに、この2系統のマウスの前脳および小脳のmRNAをもちいたNorthern blot解析を行ったところ、1系統(ECP25)の小脳でCrePR mRNAの高い発現が検出された。In situ hybridizationの結果、ECP25系統マウスの小脳でCrePR mRNAが顆粒細胞特異的に発現していることが確認された。しかしながら、X葉とIX葉の尾側部では発現が確認されなかった。 ECP25系統におけるCrePRの発現が確認されたことから、次にアンチプロゲステロン投与依存的なCreリコンビナーゼ活性発現の検討を行った。loxP配列間の組み換えにより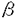 -ガラクトシダーゼを発現するトランスジーンをもつレポーターマウス(CAG-CAT-Z11)とECP25系統を掛け合わせ、両トランスジーンを有するF1マウスを解析に用いた。アンチプロゲステロン(Org 31806)1.3mgを一日一回マウスに腹腔内投与し、4日間連続投与の後3日目に4%パラホルムアルデヒドで灌流固定し、1mm厚切片を作成、LacZ染色を行った。アンチプロゲステロン投与マウスの脳切片で -ガラクトシダーゼを発現するトランスジーンをもつレポーターマウス(CAG-CAT-Z11)とECP25系統を掛け合わせ、両トランスジーンを有するF1マウスを解析に用いた。アンチプロゲステロン(Org 31806)1.3mgを一日一回マウスに腹腔内投与し、4日間連続投与の後3日目に4%パラホルムアルデヒドで灌流固定し、1mm厚切片を作成、LacZ染色を行った。アンチプロゲステロン投与マウスの脳切片で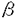 -ガラタトシダーゼによる青色の染色が小脳顆粒細胞層で確認された。mRNAの発現と同様にX葉とIX葉の尾側部では染色が確認されなかった。溶媒のみを投与したコントロールマウスの脳切片ではわずかな染色が小脳顆粒細胞層で確認された。以上の解析結果から、ECP25系統が小脳顆粒細胞特異的にCrePRを発現し、アンチプロゲステロンの腹腔内投与によるCre活性の誘導で効率良く組み換えを起こすことが示された。 -ガラタトシダーゼによる青色の染色が小脳顆粒細胞層で確認された。mRNAの発現と同様にX葉とIX葉の尾側部では染色が確認されなかった。溶媒のみを投与したコントロールマウスの脳切片ではわずかな染色が小脳顆粒細胞層で確認された。以上の解析結果から、ECP25系統が小脳顆粒細胞特異的にCrePRを発現し、アンチプロゲステロンの腹腔内投与によるCre活性の誘導で効率良く組み換えを起こすことが示された。 標的遺伝子組み換えの時期はCrePRを用いることでコントロールが可能となった。このシステムは短期間のアンチプロゲステロン腹腔内投与で脳内での遺伝子組み換えの誘導が可能であることから、内在性のレセプターに与える影響は少ない。さらに、今回はアンチプロゲステロンの中でもプロゲステロンレセプターに特異性の高いOrgを使用した。そして、NMDA型GluR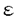 3サブユニットのプロモーター領域を使用し、X葉とIX葉尾側部を除いた小脳顆粒細胞層でCrePRの発現が得られた。本来のGluR 3サブユニットのプロモーター領域を使用し、X葉とIX葉尾側部を除いた小脳顆粒細胞層でCrePRの発現が得られた。本来のGluR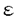 3サブユニットの発現は小脳顆粒細胞層に強く、olfactory bulb,thalamusに弱く認められることから、使用した領域は以前に報告のある転写に必要な基本的なプロモーターを含んでいるが、今回発現の見られなかった部位は異なる発現制御を受けていることが考えられる。また、マウスの作成にあたっては記憶・学習の解析に適したC57BL/6の遺伝子背景で統一することを考慮して行った。 3サブユニットの発現は小脳顆粒細胞層に強く、olfactory bulb,thalamusに弱く認められることから、使用した領域は以前に報告のある転写に必要な基本的なプロモーターを含んでいるが、今回発現の見られなかった部位は異なる発現制御を受けていることが考えられる。また、マウスの作成にあたっては記憶・学習の解析に適したC57BL/6の遺伝子背景で統一することを考慮して行った。 本研究において小脳顆粒細胞特異的にアンチプロゲステロンの投与によって遺伝子組み換えを誘導できる方法が確立できたことにより、LTPを始めとする顆粒細胞を介した記憶・学習の機構の解明が大きく進歩することが期待される。また、今回の結果からCrePR/loxPシステムが脳において有効であることも証明された。プルキニエ細胞特異的に発現する遺伝子のプロモーターを用いてCrePRマウスを作成し、前シナプス性・後シナプス性の分子機構の解析を行うことで平行線維-プルキニエ細胞間のシナプスの記憶・学習におけるに対する理解が深められるだろう。 |