リゾホスファチジン酸(LPA)は細胞増殖、神経細胞の神経突起退縮、細胞遊走能、細胞膜脱分極、血液凝固など多種多様な生理活性をもつリン脂質である。この生理作用はG蛋白質を介していることが明らかとなり、近年、LPAに対するレセプターも数種クローニングされている。このようなLPAの多様なシグナリングを制御することは生体にとって重要であり、そのためLPAを特異的に分解する酵素を解析することはLPAの生理作用を理解する上で有意義と考えらえる。 牛脳サイトゾル画分にLPA分解活性が検出されたため、それを<35%、35-45%、45-55%、55-80%の硫安分画を行い細分化した。45-55%の画分に最も高い比活性が確認され、この画分からQ-セファロース、DEAE、ゲル濾過、ヘパリンカラムを用いてLPA分解酵素をSDS-PAGE上、単一バンドにまで精製した。 この酵素はSDS-PAGE上、約44kDaの分子量を有し、その活性はTritonX-100、CHAPS、コール酸、オクチルグルコシドなどの界面活性剤に依存的であり、二価陽イオン非依存的であった。また、この酵素を[3H]-LPAと反応させた後、薄層クロマトグラフィーにて解析を行った結果、分解産物にモノアシルグリセロールが検出され、この酵素がホスファターゼであることが確認された。そのため、この酵素をLPAホスファターゼ(LPAP)と名付けた。 各ステップにおける比活性及び濃縮度を以上の至適条件にて求めた。最終ステップのヘバリンカラム後には比活性1.1units/mgであり、牛脳サイトゾル画分の3300倍にまで濃縮された。さらに、LPAPに対するkineticsアッセイを行い、Vmax及びKm値を求めた。基質としてLPAとTritonX-100の混合ミセルを用いた場合、Vmax=11.37(units/mg)、Km=37.99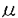 Mであった。 Mであった。 次に、LPAPの基質特異性をLPAのアナログを基質に用いて行った。LPAPはセラミド1リン酸、スフィンゴシン1リン酸、グリセロールリン酸(GP)、カルジオリピン(CL)、ビスホスファチジン酸(BisPA)を分解しなかった。また、ホスファチジン酸(PA)を僅かに分解したものの、LPAの1/10程度の活性であり、LPAに非常に特異的であった。 PAホスファターゼの関与を否定するためPAホスファターゼの阻害剤を用いて、さらにその性質を調べた。NaF及びNEMは強い活性阻害作用を示したが、プロプラノロールは0.5mMまで活性を促進させ、それ以上の濃度では活性を阻害した。 阻害剤による感受性及び二価陽イオン要求性、さらに、分子量からこの酵素がLPAを特異的に分解する新規の蛋白質であることを明らかにした。 LPAPのcDNAクローニングをすることを目的に、精製したLPAPをリジルエンドペプチダーゼで断片化し、その断片のペプチドシークエンスを行った。ペプチドシークエンスにより6つのペプチドを解析し、得たペプチドをホモロジーサーチした結果、そのうち2つについて酸性ホスファターゼと高い相同性が認められた。この相同性の高いペプチドの配列を基にdegenerateプライマーを作製し、ヒトcDNAライブラリーを鋳型にPCRを行った。PCRにより987塩基のDNAフラグメントが得られた。さらに、このDNAフラグメントをプローブに用いてプラークハイブリダイゼーションを行いLPAPの全長をコードするcDNAを得た。このcDNAは421残基のアミノ酸をコードし、ヒト前立腺酸性ホスファターゼと28.5%の相同性を示した。さらに、N末端にはputativeなシグナルペプチドを有していた。 ノーザンブロット解析により、LPAPの組織分布を調べた。LPAPの発現は広範にわたっていたが、腎臓、心臓、小腸、筋肉、肝臓に特に多く発現していた。また、FISHによる遺伝子座の解析により、LPAPがヒト染色体1q21に位置することが明かとなった。 LPAPの活性部位と細胞内局在を調べるため、ヒト酸性ホスファターゼの活性部位に相当するヒスチジンをアラニンに変換した変異体とN末端のputativeシグナルペプチドを欠損した変異体を作製しCOS7細胞に過剰発現させた。COS7細胞への過剰発現により、LPAPがシグナルペプチド依存的にミトコンドリアに局在し、ヒト酸性ホスファターゼと同様の活性部位を介してLPAP活性を生じることを明らかにした。さらに、内因性LPAPの細胞内局在を調べるため、ノーザンブロット解析で発現が多く認められた腎臓の細胞(MDCK細胞)と筋肉の細胞(C2C12細胞)を用いて細胞染色を行った。その結果、MDCK細胞及び筋管細胞に分化したC2C12細胞でLPAPのミトコンドリアへの局在が確認された。しかし、未分化型の筋芽細胞C2C12細胞では細胞染色出来なかった。このため、分化時におけるC2C12細胞でのLPAP発現とLPAP活性を経日的に調べた結果、LPAP発現がC2C12細胞の分化に伴い誘導されることを明かにした。 LPAPと酸性ホスファターゼの中で最も相同性の高かったヒト前立腺酸性ホスファターゼの基質特異性を比較するため、それぞれをCOS7細胞に過剰発現させ、その細胞抽出液をDEAEカラムにて粗精製したものを酵素液としてin vitroでアッセイを行った。細胞に過剰発現したヒトのLPAPは牛脳から精製したLPAP同様、LPAに特異的であった。ヒト前立腺酸性ホスファターゼはLPAを強く分解したものの特異性は弱く、PA及びGPもLPAの1/2程度分解した。さらに、ヒト前立腺酸性ホスファターゼで報告されているようなチロシンホスファターゼ活性をLPAPが有するかを調べた。リン酸化EGFレセプターを基質として、in vitroでLPAPと反応させた結果、LPAPはリン酸化EGFレセプター脱リン酸化能を有しており、その活性はTritonX-100で抑制されることが分った。 LPAPの細胞内での機能を解析するため、LPAPをNIH3T3細胞に安定的に発現した細胞を樹立し、LPAP発現による細胞内リン脂質の変化を調べた。その結果、ミトコンドリアに多く存在するカルジオリピン(CL)とホスファチジルグリセロール(PG)の合成が減少していた。LPAPがCLやPG、さらに、これらの前駆体であるホスファチジルグリセロホスフェート(PGP)を分解するかどうかin vitroで調べた結果、LPAPはこれらのリン脂質を分解しなかった。 この結果はLPAPがde novoのリン脂質代謝系において、グリセロール-3-リン酸(G3P)からPAが合成される際の中間体であるLPAを分解し、ミトコンドリアにおけるリン脂質代謝を制御している可能性を示している。さらに、LPAPはミトコンドリアのリン脂質をコントロールすることにより、ミトコンドリア機能も制御している可能性が示唆された。 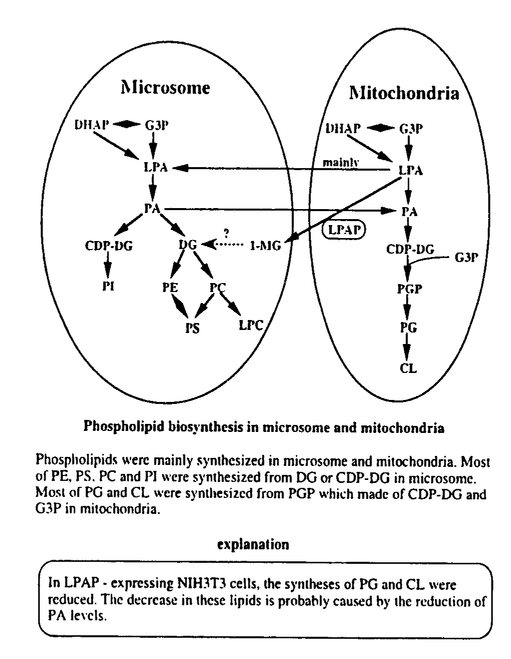 図表 図表 |