腫瘍の形成は、複数の遺伝子の変異によって引き起こされる。それは、癌遺伝子の活性型への変異や、癌抑制遺伝子の不活性化に依ることから、癌遺伝子のドミナントネガティブ変異体や癌抑制遺伝子を癌細胞に導入し遺伝的な異常を修正することによって、癌治療効果が得られるのではないかと考えられる。本研究は、その根底を支える方法論として、ヒト固形癌由来細胞株にこのような癌抑制遺伝子を効率よく導入するレトロウイルスベクター系を確立し、さらにその遺伝子の生物学的効果を評価することを目的とした。 癌遺伝子の機能はこれまで、ニワトリ胚線維芽細胞や齧歯類の線維芽細胞を用いて解析されることが多かった。転写制御因子AP-1はFosファミリーおよびJunファミリータンパク質によって構成されるが、これらはいずれも、過剰発現や活性型変異の獲得によって、細胞をトランスフォームすることができる。また、v-Fosやc-Jun、JunDのドミナントネガティブ変異体が、Fos、Junの過剰発現によるトランスフォーメーションだけでなく、src、yes、fps、ras、rafといった癌遺伝子によるトランスフォーメーションをも抑制することから、このような単一の癌遺伝子による細胞のトランスフォーメーションには内在性のAP-1の機能が重要であると考えられる。しかし、多段階発癌によるヒト腫瘍細胞におけるAP-1の役割はほとんど知られていない。そこで、ヒト癌細胞株への効率的な遺伝子導入法としてVSV-Gシュードタイブレトロウイルスベクター産生系の開発を行い、これを用いてAP-1のドミナントネガティブ変異体をヒト癌細胞株に導入することによって、ヒト細胞の癌化におけるAP-1の役割の解析することから研究を開始した。 VSV-Gシュードタイプレトロウイルスベクターの投与量と導入効率の関係は、ポアソン分布にしたがって感染が起こった場合に期待されるものに極めて近く、1回のトランスダクションで容易に全ポピュレーションに多コピーの遺伝子導入が可能であり、導入した遺伝子の細胞内での機能を薬剤選択なしに評価が可能であった。lacZを発現するベクターを用いて、プレパッケージ細胞PtG-S2でのウイルス産生の至適化を行った後、AP-1のドミナントネガティブ変異体であるsupjunD-1を発現するVSV-Gシュードタイプレトロウイルスベクターの産生を試みると、高力価のSupJunD-1ウイルス(2×105感染粒子/ml)を産生することができた。 まず、活性型K-RasでトランスフォームしたNIH3T3(NIH3T3/Ras)を用いて、SupJunD-1の足場非依存性増殖の抑制活性を検討した。細胞内のプロウイルスのコピー数を制御するため、いろいろなMOIでSupJunD-1ウイルスを導入した後、それぞれの細胞の軟寒天中でのコロニー形成活性を検討した。細胞あたり約10コピーのsupjunD-lを導入した場合には、ほぼ完全に足場非依存性増殖が抑制されたが、約1コピーの遺伝子導入をした場合は約60%の抑制にとどまった。さらに、骨肉腫(U2-OS、Saos-2)、非小細胞肺癌(A549、Hl299)、子宮頚癌(Hela、SiHa)由来のヒト癌細胞株にSupJunD-1ウイルスをそれぞれMOI10で導入したところ、すべての癌細胞株で足場非依存性増殖の抑制が見られ、U2-OSやA549では90%以上の抑制効果が観察された(表1)。また、Saos-2やHelaではコロニー数の減少と同時に、1つ1つのコロニーの大きさの減少が見られた。 次に、SupJunD-1ウイルスを導入した細胞株の単層培養での倍加時間と飽和濃度を検討した。コントロールのNIH3T3(NIH3T3/Neo)やNIH3T3/Ras、U2-OS、Saos-2に約1コピーのsupjunD-1を導入しても、倍加時間、飽和濃度ともにほとんど影響がなかった。一方、約10コピーのsupjunD-lを導入すると、NIH3T3/Neo、U2-OS、Saos-2、A549などの細胞株では倍加時間が増加し、NIH3T3/Neo、NIH3T3/Ras、Saos-2、Helaなどの細胞株では飽和濃度が減少した。しかし、このようなsupjunD-1の高レベル発現でも、Hl299やSiHaでは増殖にほとんど影響は見られなかった(表1)。 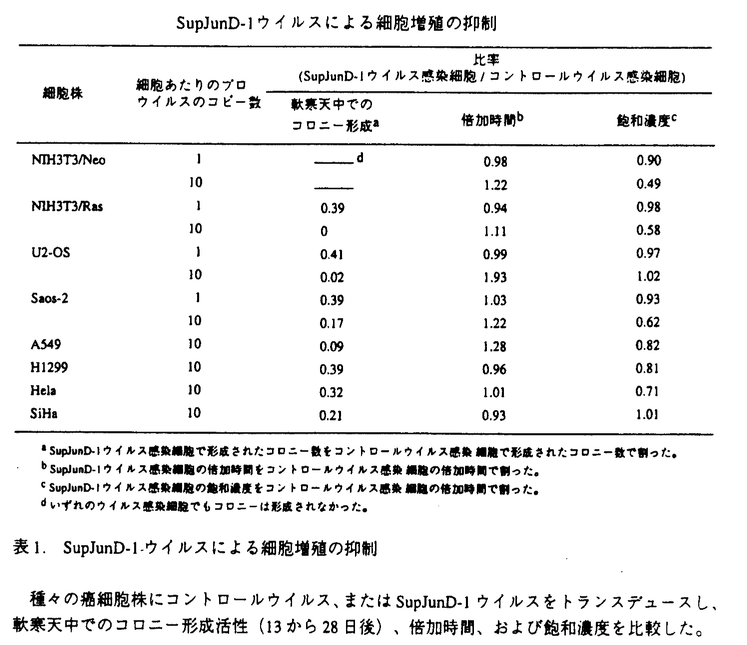 表1.SupJunD-1-ウイルスによる細胞増殖の抑制種々の癌細胞株にコントロールウイルス、またはSupJunD-lウイルスをトランスデュースし、軟寒天中でのコロニー形成活性(13から28日後)、倍加時間、および飽和濃度を比較した。 表1.SupJunD-1-ウイルスによる細胞増殖の抑制種々の癌細胞株にコントロールウイルス、またはSupJunD-lウイルスをトランスデュースし、軟寒天中でのコロニー形成活性(13から28日後)、倍加時間、および飽和濃度を比較した。 これらの結果は、多種類のヒト癌由来細胞株においても、その癌化には内在性AP-1が重要な働きをすることが示された。また、多くの癌細胞株においてSupJunD-1が足場非依存性増殖を著しく抑制する条件下でも、単層培養では倍加時間や飽和濃度に大きな影響を与えなかったことから、発癌活性を高い特異性で抑制するものと考えられる。また、細胞あたり約1コピーのsupjunD-1では癌細胞株だけでなくNIH3T3の倍加時間や飽和濃度への影響はほとんど見られないことから、正常細胞への影響も比較的小さい遺伝子であることも明らかになった。 SupJunD-1が内在性AP-1のダイマーの分子構成に与える影響について調べるため、コントロールウイルス、またはSupJunD-1ウィルスを導入した細胞株の核抽出液を用いて、ゲルシフトアッセイを行った。ヒトのコラゲナーゼにあるAP-1結合DNA配列をプローブとして解析すると、コントロールウイルス感染細胞では単一のバンドAのみが検出されたが、SupJunD-1ウィルス感染細胞ではバンドAのみでなく、泳動度がより早いバンドBがより強い強度で検出された。特異抗体を用いた解析から、バンドAは内在性Fosファミリーと内在性Junファミリーのダイマーであり、バンドBは内在性Fosファミリーとウイルスで導入したSupJunD-1のダイマーであることが示された。SupJunD-1は予想通り、内在性AP-lのダイマーの分子構成を著しく変化させ、その大半を転写活性化能の低いFos/SupJunD-1ダイマーへと変換していた。 次に、supjunD-1よりも、細胞傷害性や細胞増殖抑制活性の高い癌抑制遺伝子を発現するVSV-Gシュードタイプレトロウイルスベクター産生系の構築を試みた。このような遺伝子を発現するウイルスを産生する安定なパッケージ細胞の樹立は、これらの遺伝子発現のパッケージ細胞に対する悪影響のために、これまでは困難であった。そこで、パッケージ細胞中でのウイルスベクター内の外来遺伝子の発現を、Cre recombinaseによってall-or-noneに厳密に制御できる転写ユニットpBabeLPLを設計した(図1)。外来遺伝子にlacZを持つ転写ユニットを導入したPtG-S2のクローニングをし、そのウイルス産生活性の至適化を行ったところ、アデノウイルスベクターでCrerecombinaseを導入すると、4×105感染粒子/mlのLacZウイルスが産生される系が確立できた。また、Cre recombinase導入前にはウイルスは全く産生されなかった。そこでこの系を用いて、代表的な癌抑制遺伝子であるp53を発現するVSV-Gシュードタイプレトロウイルスベクターの産生を試みると、高力価のp53ウイルス(4×105感染粒子/ml)を産生することが可能となった。 次に、ベクターDNA内のloxP配列間の組み換えが設計通りに起こっているかを、Crerecombinase導入前後のパッケージ細胞からゲノムを抽出しサザンブロティングで検討した。すると、loxP配列間で組み換えが起こった時に予想される長さのバンドのみが検出された。トランスデュースされたプロウイルスの形をp53ウイルストランスダクション前後の細胞からゲノムを抽出しサザンブロティングで検討した。トランスダクション前にはバンドが検出されなかったのが、トランスダクション後には設計通りのプロウイルスの長さの単一のバンドが検出された。したがって設計通りの形のレトロウイルスのみが産生され、トランスデュースされた細胞のゲノムに組み込まれたと考えられる。 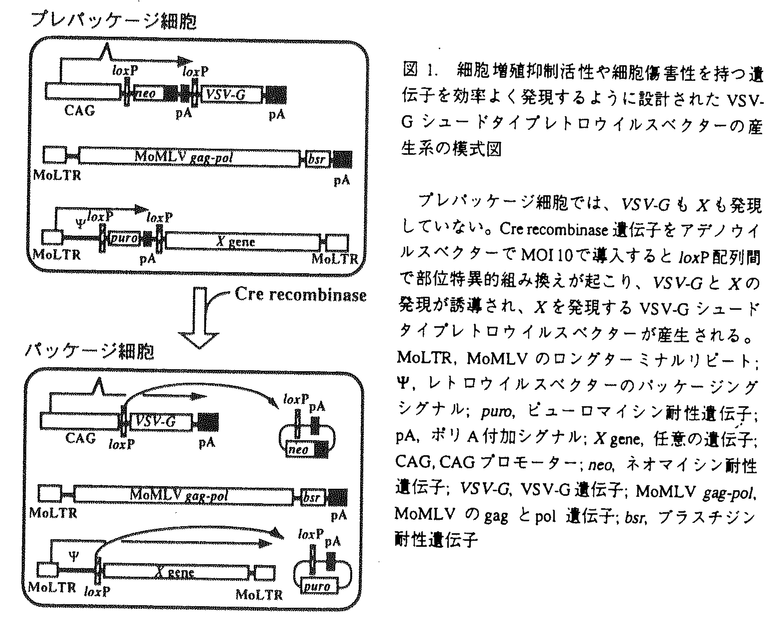 図1.細胞増殖抑制活性や細胞傷害性を持つ遺伝子を効率よく発現するように設計されたVSV-Gシュードタイプレトロウィルスベクターの産生系の模式図プレパッケージ細胞では、VSV-GもXも発現していない。Cre recombinase遺伝子をアデノウイルスベクターでMOI10で導入するとloxP配列間で部位特異的組み換えが起こり、VSV-GとXの発現が誘導され、Xを発現するVSV-Gシュードタイプレトロウイルスベクターが産生される。MoLTR,MoMLVのロングターミナルリピート; 図1.細胞増殖抑制活性や細胞傷害性を持つ遺伝子を効率よく発現するように設計されたVSV-Gシュードタイプレトロウィルスベクターの産生系の模式図プレパッケージ細胞では、VSV-GもXも発現していない。Cre recombinase遺伝子をアデノウイルスベクターでMOI10で導入するとloxP配列間で部位特異的組み換えが起こり、VSV-GとXの発現が誘導され、Xを発現するVSV-Gシュードタイプレトロウイルスベクターが産生される。MoLTR,MoMLVのロングターミナルリピート; ,レトロウイルスベクターのパッケージングシグナル;puro,ピューロマイシン耐性遺伝子;pA,ポリA付加シグナル;Xgene,任意の遺伝子;CAG,CAGプロモーター;neo,ネオマイシン耐性遺伝子;VSV-G,VSV-G遺伝子;MoMLV gag-pol,MoMLVのgagとpol遺伝子;bsr,ブラスチジン耐性遺伝子 ,レトロウイルスベクターのパッケージングシグナル;puro,ピューロマイシン耐性遺伝子;pA,ポリA付加シグナル;Xgene,任意の遺伝子;CAG,CAGプロモーター;neo,ネオマイシン耐性遺伝子;VSV-G,VSV-G遺伝子;MoMLV gag-pol,MoMLVのgagとpol遺伝子;bsr,ブラスチジン耐性遺伝子 産生されたp53ウイルスの生物活性を調べるため、3YlおよびU2-OSにMOI10でのトランスダクションを行い免疫染色を行ったところ、細胞の全ピュレーションでp53の発現が検出され、細胞増殖の阻害が検出された。増殖への影響をFACSで調べたところ、p53ウイルス導入によって細胞周期Gl期での停止が観察された。同様に、プレパッケージ細胞PtG-S2にもp53ウイルスをMOI10でトランスダクションを行うと、細胞周期G1期での停止が観察された(図2)。したがって転写ユニットpBabeLPLを用いることによって、PtG-S2でも高力価のp53ウイルスを産生することが可能になったと考えられる。 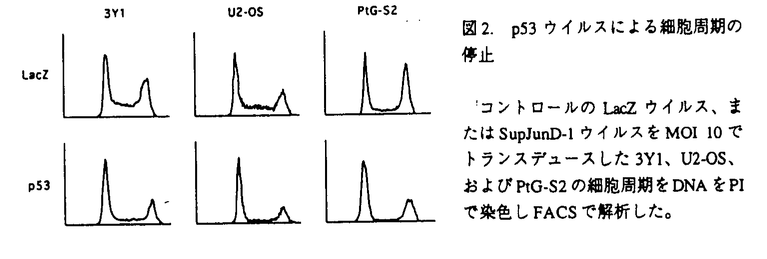 図2.p53ウイルスによる細胞周期の停止コントロールのLacZウイルス、またはSupJunD-1ウイルスをMOI 10でトランスデュースした3Y1、U2-OS、およびPtG-S2の細胞周期をDNAをPIで染色しFACSで解析した。 図2.p53ウイルスによる細胞周期の停止コントロールのLacZウイルス、またはSupJunD-1ウイルスをMOI 10でトランスデュースした3Y1、U2-OS、およびPtG-S2の細胞周期をDNAをPIで染色しFACSで解析した。 本研究では、癌遺伝子AP-1のドミナントネガティブ変異体、および癌抑制遺伝子p53を効率よく発現するVSV-Gシュードタイプレトロウイルスベクター産生系の構築を行い、多くのヒト癌細胞由来細胞株でその発癌活性を薬剤などでの選択なしに極めて高い効率で抑制できることを示した。今後はこの系を用いて、その他の様々な発癌抑制活性をもつと考えられる遺伝子を効率よく発現することが可能になるものと期待される。このウイルスを使うことにより、ヒト癌細胞における発癌機構の解明が進むだけでなく、正常細胞における癌抑制遺伝子の影響も評価できると考えられる。さらに、発癌マウスモデルを用いたin vivoでの癌治療効果の検討も行えると期待される。 |