| 内容要旨 | | 生物は、自己の生命活動を維持する為に、様々な生命現象を営んでいる。その恒常性の維持(ホメオスタシス)において、金属分子は重要な機能を果たしている。多種多様な金属が生体内に存在する中、微量しか存在していないFe、Co、Ni、Cu又は、Zn等の遷移金属は、ポリベプチドに結合した形で存在し、タンパク質又は、酵素分子の機能発現や、立体構造の安定化等と密接に関与している。特に、FeとCuは、細胞の呼吸機能において重要な役割を果たしている。一方、酵素を含めたタンパク質分子は、生命現象の最も中心的な役割を担う生体物質である。そのタンパク質分子は、多様な機能を発現するために固有の立体構造を有しており、その構造は一本鎖のポリベプチドから成っているものから,複数のサブユニットから成っているものまで様々である。多くのタンパク質の立体構造が、近年のX線結晶解析をはじめとする分析技術の向上に伴って、明らかにされてきた。しかしながら、その立体構造が細胞内又は、試験官内でどのように形成(フォールデイング、アセンブリー)されているのかは、よく理解されていない。その上、サブユニット構造を有するものや、膜に局在しているタンパク質に至っては、生体内重要な役割を果たしているにも係らず解析例が非常に少ない。 コハク酸-ユピキノン還元酵素(SQR)は細菌の細胞質膜又は、ミトコンドリアの内膜に局在し,好気的エネルギー代謝におけるクエン酸回路と呼吸鎖電子伝達系を直接結ぶ重要な機能を果たしている。大腸菌由来の本酵素はsdhCDAB遺伝子によりコードされる異なった四つのサブコニットから構成されており、細胞質側に露出しコハク酸酸化に必要な触媒部位及び、ヘムbを含み膜中に存在するユビキノンへの電子伝達能を有する膜アンカー部位の二つの機能部位により構成されている膜酵素である(Figure 1)。その触媒部位は、フラビンを共有結合している64kDaタンパク質(Fp)及び、3種の鉄-硫黄クラスター([2Fe-2S]、[4Fe-4S]及び、[3Fe-4S])を含む27kDaタンパク質(Ip)により形成され、コハク酸から水溶性の人工電子受容体への電子伝達を触媒(コハク酸脱水素酵素、SDH)する。更に1分子のヘムbを架橋した14kDaの大及び、13kDaの小の二つのサブユニット(cybL及び、cybS)により膜アンカー部位(シトクロムb556)が形成されている。このサブユニット構成は、大腸菌からヒトに至るまで共通しており、その上、SQRは、呼吸鎖電子伝達系を構成している酵素群の中では最もサブユニット数が少なく、分子量も小さい複合体である。 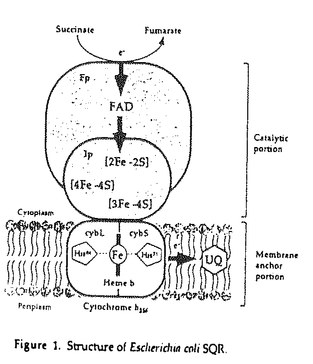 Figure 1.Structure of Escherichia coli SQR. Figure 1.Structure of Escherichia coli SQR. 本研究において、私は大腸菌SQRに含まれているヘム分子、その中でも特に,ヘム鉄が本酵素の膜へのアセンブリーに必須であること、更に、分子シャペロンがその触媒部位の形成に関与していることを大腸菌変異株を利用した遺伝生化学的手法により明らかにした。 1.大腸菌SQRにおけるヘムの役割1-1大腸菌SQRの膜へのアセンブリーにおけるヘム鉄の役割 ヘム生合成能を欠いた大腸菌変異株が、好気的呼吸能及び、シトクロム合成能を欠損することが以前から知られていた。又、ヘム生合成能変異株の一つである大腸菌hemA(ヘム生合成系における初期段階、グルタミル-tRNA還元酵素をコード、5-アミノレブリン酸要求性株)変異株において、本来、細胞膜にあるべきSQRの触媒部位(Fp-Ip)が細胞質に蓄積し、膜に存在するユピキノンへの電子伝達能を欠損することが、最近、私の所属するグルーブの研究により明らかになってきた[1]。つまり、細胞内でのヘムの生合成がSQRの構造形成及び、機能発現に関与することが示唆されていた。 一方、シトクロム類を含むヘムタンパク質に含まれるヘム分子は、酸化還元能及び、低分子のリガンドの結合能等の機能のみならず、構造的な要因としても非常に重要な役割を果たしている。又、ヘム分子中のポルフィリン環は、タンパク質分子内の疎水的要因としての役割を果たすことが知られている。そこで、私は、大腸菌SQRの構造形成及び、触媒機能におけるヘム、特に中心金属であるヘム鉄の役割について明らかにする為に、ヘム生合成系における最終段階のプロトポルフィリン(PPIX)に鉄を配位させる機能を欠いたhemH(フェロキラターゼをコード)変異株を用いて、その解析を試みることにした(Figure 2)。hemH変異株VS200は、鉄の配位していないプロトポルフィリンを細胞内に蓄積し、可視光感受性の表現型を示す[3]。又、hemH変異株VS212は、ヘム(ヘミン)の透過性を亢進した(hemper)二重変異株であり、培地に含まれるヘミンを細胞内に取り込み好気的呼吸能を回復する。先ず初めに、各々のhemH変異株を用いてSQRの酵素活性(SDH 及び、SQR活性)発現とその局在を測定した。 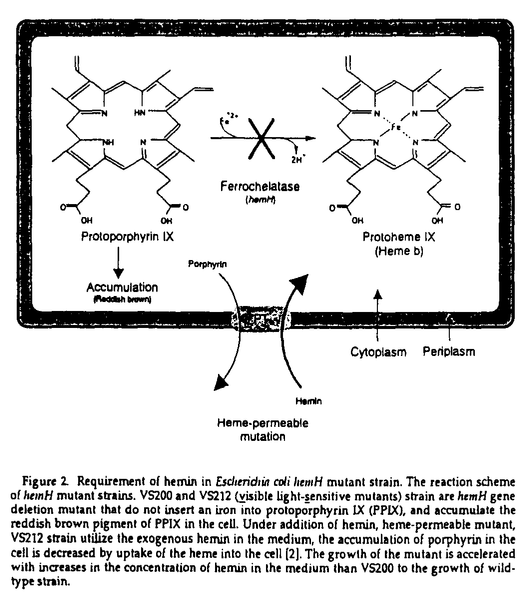 Figure 2.Requirement of hemin in Escherichin coli hemH mutant strain.The reaction scheme of hemH mutant strains.VS200 and VS212(visible light-sensitive mutants)strain are hemH gene deletion mutant that do not insert an iron into protoporphyrin IX (PPIX),and accumulate the reddish brown pigment of PPIX in the cell.Under addition of hemin,heme-permeable mutant, VS212 strain utilize the exogenous hemin in the medium,the accumulation of porphyrin in the cell is decreased by uptake of the heme into the cell [2].The growth of the mutant is accelerated with increases in the concentration of hemin in the medium than VS200 to the growth of wild type strain. Figure 2.Requirement of hemin in Escherichin coli hemH mutant strain.The reaction scheme of hemH mutant strains.VS200 and VS212(visible light-sensitive mutants)strain are hemH gene deletion mutant that do not insert an iron into protoporphyrin IX (PPIX),and accumulate the reddish brown pigment of PPIX in the cell.Under addition of hemin,heme-permeable mutant, VS212 strain utilize the exogenous hemin in the medium,the accumulation of porphyrin in the cell is decreased by uptake of the heme into the cell [2].The growth of the mutant is accelerated with increases in the concentration of hemin in the medium than VS200 to the growth of wild type strain. その結果、各々のhemH変異株中の細胞粗抽出液、細胞質及び、細胞膜の各々の画分において、SDH及び、SQR活性は検出されなかった。一方、ヘミン(ヘムb)を添加した培養条件下において、VS212株細胞中の細胞膜画分に、SDH及び、SQRの酵素活性が検出された。これは、鉄の配位していないプロトポルフィリンのみでは、SQRの構造形成や、機能発現において不十分であり、SQRの構造形成や、機能発現にヘム鉄が必須であること示している。 更に詳細な解析を進める上で、ヘミン非存在下で培養したhemH変異株においては、グルコースを添加した場合でも、染色体上のsdhCDABオペロンから発現する本酵素の活性値は非常に低く、解析には困難であった。そこで、以前に、sdh遺伝子を挿入したプラスミドのhemA変異株への導入により、細胞中のsdh産物の局在を示すことに成功している点を参考[1]にし、より明瞭な結果を得る為に、sdhオペロンを含んだプラスミド(pSDH03)を導入したhemH変異株を解析に用いた。その結果、やはり、ヘミンを添加した培養条件下において、細胞膜中に顕著なSDH及び、SQR活性が検出された。一方、ヘミンを加えない培養条件下においては、やはりSDH又はSQR活性は殆ど検出されなかった。 この結果の中で、これまでのhemA変異株H500を用いた時に得られた結果と少し、異なっていた。即ち、ヘム飢餓の条件下で培養したSdhオペロンをコードするプラスミドを導入したH500株中においては、SDH活性が細胞質画分に検出されている[1]。それに対し、VS200及び、VS212株においては、sdhをコードしたプラスミドを導入したにもかかわらず、SDH活性が細胞質画分に検出されなかった。一方、ウエスタンプロッティング解析からは、触媒部位の局在を示すFpベプチドは、細胞質画分に検出され、又、ヘミンを加えない培養条件下のVS212株細胞内において、高い値のPPIX量が検出された。この問題点を明らかにする為に、Plファージによる形質転換法を用いることによってVS212株にhemA変異を導入し、hemA hemH hemper三重変異株CN603を作成した。更に、hemH変異株と同様に、プラスミドpSDH03をCN603株に導入し、SDH又はSQR活性の局在を調べた。その結果、三重変異株においても、VS212の場合と同じ様に、ヘミンを加えて培養した場合、細胞膜画分に最も高いSDH及び、SQR活性が検出された。又、ヘミンを加えずに培養した場合は、細胞質中にSDH活性が検出された。hemA変異株では、ヘム生合成初期段階が欠損しているのでPPIXの蓄積は見られない事と合わせ、VS200や、VS212株等のhemH変異株においては細胞質中の触媒部位がPPIXによって不活性化されたと考えられる。 最近、私の所属するグループの研究から、シトクロムb556のヘム鉄の第5、6番目の軸配位子であるcybL-His84又は、cybS-His71の一方を他のアミノ酸に置換した変異株は、ヘムを結合していないにもかかわらず、その活性は細胞膜に局在し、ユビキノンへの電子伝達能を有することが解ってきた[3]。この事は四量体のSQRが、一度、細胞膜に構造形成(アセンブリー)した後は、その電子伝達活性にヘム分子は関与していない事を示している。即ち、SQRに含まれているヘム分子は触媒機能より、むしろアセンブリーにおける役割を果たしていると考えられる。 本研究結果とこれまでの報告から、大腸菌SQRに含まれているヘムb(ヘム鉄)は、膜へのアセンプリーに必須であり、シトクロムサプユニット中の軸配位子によるヘム鉄への配位が大腸菌SQRのアセンブリーにおいて重要な過程である事が示された。更に、このヘムを結合したシトクロムサプユニットの構造が、触媒部位のFp、Ipの膜への結合させるのに必要な要因であることが明らかになった。 1-2大腸菌SQRのアセンブリーにおける中心金属の特異性 以上の結果に基づいて、次にこのヘミン透過性の特徴を利用し、大腸菌SQRのアセンプリーにおけるヘム中心金属の特異性について明らかにする目的でヘム鉄を他の金属に置換し、その影響を調べた。培養の際、ヘミン(Fe-PPIX)の代りに、中心金属が、Mn、Co、Ni、Cu又は、Znが配位したプロトポルフィリンIX(PPIX)を添加して培養した菌を用いて解析を行った。 その結果、ヘミンをMn-、Co-、Ni-、Cu-又は、Zn-PPIXに換えた時、菌の増殖は激減した。又、鉄以外の金属ポルフィリン(MPs)存在下で培養した細胞由来の細胞粗抽出液画分中において、低いSDH活性が検出された。これらの活性は、細胞膜画分に局在し、それらの殆どがFe-PPIXを加えたときの3%以下であった。この中で、Mn-PPIXの存在下で培養した細胞のSDH及び、SQR活性は、Fe-PPIXを加えたときの約10から15%ではあるが、他の金属に置換したもの比べて高い比活性の値を示した。ウエスタンプロッティング解析でFpペプチドは細胞質に検出されたが、Table 1-2に示すようなMn又は、Fe以外のMPsの存在下で培養した場合、細胞質画分にSDH活性は、全く検出されなかった。これは、ヘム透過性変異株細胞にFe以外のMPsが輸送されることによって、細胞質中のSDH活性が不活性化されていると考えられる。以上、の金属特異性は、錯体を形成する際の中心金属における配位子による配位数や、中心金属のイオン半径等の物理化学的性質を反映しているものと考えられる。例えば、Mn(II)は、六配位八面体構造の錯体を形成することが可能なので、僅かではあるが、活性を示したと考えられる。 以上の結果から、大腸菌SQRのアセンプリーは、ヘム鉄に特異的であることが明らかとなり、鉄の配位したポルフィリンがSQRアセンプリーに必要であることが判った。 2.大腸菌SQRの構造形成び機能発現における分子シャペロンの役割2-1.分子シャペロン遺伝子変異による好気的呼吸鎖への影響 細胞内において、タンパク質の立体構造形成過程に、分子シャペロンと呼ばれる介添えタンパク質の存在が明らかになっており、タンパク質との相互作用を通じて、細胞の正常な代謝や生存に必須の役割を担っている。Haddockらは大腸菌好気的呼吸鎖のin vitroにおける再構成にヘムに加えてATPの添加が必要であることを報告している。これは、ATP依存性の分子シャペロン(熱ショックタンパク質、Hsp)の呼吸鎖における膜酵素複合体の構造形成への関与を示唆しているが、更に、分子シャペロン遺伝子群の変異は、大腸菌の細胞増殖に影響するので、私は分子シャペロンが呼吸代謝系に機能していると考えた。また、SQRに関しても、dnaJ変異によるSDH活性の低下が報告され、その構築に分子シャペロンの関与が示唆されている。GroEL(Hsp60)、DnaK(Hsp70)及び、HtpG(Hsp90)は、大腸菌における代表的なATP依存性の分子シャペロンである。一方、GroES(Hsp10)や、DnaJ(Hsp40)は、GroEL又は、DnaKと共役して機能する分子シャペロンである。そこで、私は分子シャペロン遺伝子の変異による好気的呼吸への影響について、呼吸鎖成分のSQRに焦点を絞り、その酵素活性と局在を調べた。 その結果、全ての分子シャペロン遺伝子変異が生理的温度(30℃)又は高温(42℃)の培養条件下で、コハク酸酸化よる呼吸活性に影響することが明らかになった。その中でも、特に呼吸活性へのgroE変異による影響が大きかった。そこで更に、SQRの酵素活性を調べたところ、生理的温度(30℃)又は高温(42℃)の培養条件下で、膜に局在するSDH活性が著しく低下していた。これは、呼吸鎖機能の維持に分子シャペロンが直接関与することを示唆している。 2-2.細胞内における分子シャペロンのSQRに対する役割:構造形成過程への参加 ここで分子シャペロンのSQRの活性発現に対する役割として、少なくとも二つの機構が考えられる。一つはSQRの発現調節、もう一つは構造形成に対する役割である。そこで、細胞内におけるSQRの発現量を調べた。 ウエスタンブロットで調べたgroEL、groES、dnaK、dnaJ及び、htpG変異株細胞中のFpの合成量は、野生株中のものと同じ(groEL及び、groES)か、それ以上(dnaK、dnaJ及び、htpG)のレベルであった。他のサブユニットについては、抗体が無い事からペブチドとしての発現の確認は困難であるが、この結果から、5dhオペロンの転写は変異株においても野生株同様に行われていると考えられ、これらの分子シャペロンは、SQRを構成するポリペプチドのフォールディングや、サブユニット構造のアセンブリーに関与していると考えられる。 2-3.SQRの触媒部位に対するgroE変異の影響 先に述べた様にヘム合成欠損変異株を用いた解析から、大腸菌SQRの生合成過程のモデルを提唱した。そこで、この変異株の利点を生かし、GroEがどの段階に作用しているのかと言う点について解析を進めた。即ち、SQRの構造形成に対するGroEの役割を調べる為に、groE変異株にhemA変異を導入することによりSQRの触媒部位(Fp-Ip)を膜から細胞質に遊離させ、これに対するgroE変異の影響を調べた。 その結果、細胞質中に存在する触媒部位の酵素活性は、GroEの欠損によって大きく低下した。更に、ポリペプチドに共有結合したFADを認識する抗体を用いて、Fpサブユニットへの影響を調べたところ、groE変異により、Fpサプユニットへのフラビンの結合量が低下していた。 以上の結果から、分子シャペロンが大腸菌の呼吸鎖電子伝達系の維持に関与し、中でもGroEがSQRの触媒部位の細胞質中での構造形成過程に重要な役割を果たしていることが明らかになった。 以上、本研究により、大腸菌SQRに含まれているヘム鉄が本酵素の膜へのアセンブリーに必要であること、更に、分子シャペロンがその触媒部位の形成、更に呼吸鎖電子伝達系の維持に関与していることが明らかになった(Figure 3)。 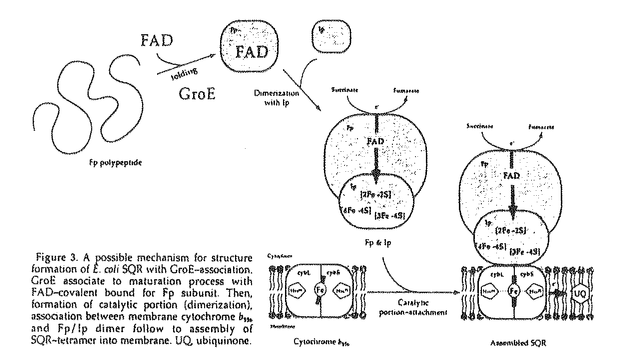 Figure 3. A possible mechanism for structure formation of E.coli SQR with CroE-association. GroE associate to maturation process with FAD-covalent bound for Fp subunit.Then,formation of catalytic portion (dimerization),association between membrane cytochrome b956 and Fp/Ip dimer follow to assembly of SQR-tetramer into membrane.UQ ubiquinone.参考文献[1]Nakamura,K.,Yamaki,M.,Sarada,M.,Nakayama,S.,Vibat,C.R.,Gennis,R.B.,Nakayashiki,T.,Inokuchi,H.,Kojima,S & Kita,K.(1996)J.Biol.Chem.,271,521-527.[2]Nakayashiki,T.& Inokuchi,H.(1997)Mol.Gen.Genet.255,376-381.[3]Vibat,C.R.T.,Cecchini,G.,Nakamura,K.,Kita,K.& Genis,R.B.(1998)Biochemistry, 37,4148-4159. Figure 3. A possible mechanism for structure formation of E.coli SQR with CroE-association. GroE associate to maturation process with FAD-covalent bound for Fp subunit.Then,formation of catalytic portion (dimerization),association between membrane cytochrome b956 and Fp/Ip dimer follow to assembly of SQR-tetramer into membrane.UQ ubiquinone.参考文献[1]Nakamura,K.,Yamaki,M.,Sarada,M.,Nakayama,S.,Vibat,C.R.,Gennis,R.B.,Nakayashiki,T.,Inokuchi,H.,Kojima,S & Kita,K.(1996)J.Biol.Chem.,271,521-527.[2]Nakayashiki,T.& Inokuchi,H.(1997)Mol.Gen.Genet.255,376-381.[3]Vibat,C.R.T.,Cecchini,G.,Nakamura,K.,Kita,K.& Genis,R.B.(1998)Biochemistry, 37,4148-4159. |