ナイーブCD4S@1+SE1T細胞は、マクロファージ(M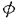 )や樹状細胞(DC)といった抗原提示細胞(APC)から提示されたMHCclassII/抗原ペプチド複合体(MHCclassII/Ag)を、T細胞受容体(TCR)により認識することで活性化されるが、その際にIL-12による副刺激を受けることにより、IL-2やIFN- )や樹状細胞(DC)といった抗原提示細胞(APC)から提示されたMHCclassII/抗原ペプチド複合体(MHCclassII/Ag)を、T細胞受容体(TCR)により認識することで活性化されるが、その際にIL-12による副刺激を受けることにより、IL-2やIFN-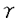 などのサイトカインを産生するヘルパーT細胞タイプ1(Th1)に分化していくことが知られている。従って、CD4+T細胞-APC相互反応によるIL-12産生機構、及びIL-12受容体(IL-12R)発現機構を解明することは、ナイープCD4+T細胞がTh1細胞へと分化していく過程や、生体内におけるTh1/Th2バランスの制御機構を解明するうえで非常に重要である。 などのサイトカインを産生するヘルパーT細胞タイプ1(Th1)に分化していくことが知られている。従って、CD4+T細胞-APC相互反応によるIL-12産生機構、及びIL-12受容体(IL-12R)発現機構を解明することは、ナイープCD4+T細胞がTh1細胞へと分化していく過程や、生体内におけるTh1/Th2バランスの制御機構を解明するうえで非常に重要である。 IL-12は分子量40kDa(p40)と35kDa(p35)の2つのサブユニットにより構成される、70kDaの糖タンパクである。p40mRNAはリポ多糖体(LPS)による刺激やヘルパーT(Th)細胞との相互反応により、IL-12産生細胞においてのみその発現が認められるのに対して、p35mRNAは多くの体細胞において恒常的に発現していると報告されている。従って、これまでのIL-12産生機構の解析はp40mRNA発現調節機構の解析に主眼が置かれていた。ところが、LPSで刺激されたヒト単球におけるIL-12産生が、p35サブユニットの発現量により調節されていることが報告されたことから、IL-12産生機構を解明するうえでp35mRNA発現調節機構を解明することは非常に重要であると考えられる。我々の研究部では、Th1クローン-APC相互反応によるIL-12産生において、p40mRNAの発現はAPC上のCD40と活性化Th1クローン上に発現誘導されるCD40リガンド(CD154)の相互反応により調節されていることを明らかにした。私は、このときにp40mRNAだけでなく、p35mRNAの発現も誘導されていることに着目し、p35mRNAの発現調節に関与する細胞表面分子を解明することを目的として研究を行った結果、以下のことが明らかになった。 1)卵白アルブミン(OVA)存在下に、OVA/I-Ab特異的Th1クローン35-9D細胞とT細胞除去(T-d)脾臓細胞が相互反応することにより、p40、p35mRNAの発現誘導、及びIL-12産生が起こる。 2)p40mRNAの発現調節に重要な役割を果たすCD154の発現は、T-d脾臓細胞との相互反応より35-9D細胞においてOVA濃度依存的に誘導され、その発現誘導は抗I-A抗体(M5/114)により完全に抑制される。 3)T-d脾臓細胞と35-9D細胞の相互反応によるp35mRNAの発現誘導は、抗CD154抗体添加による影響を受けず、OVA存在下において常に発現が誘導される。 4)T-d脾臓細胞におけるp35mRNAは、paraformaldehyde固定した休止期35-9D細胞との相互反応においても、OVA存在下にその発現は誘導され、抗I-A抗体(M51/114)添加により完全に抑制される。 5)T-d脾臓細胞を刺激活性のある抗I-A抗体(28-16-8S)で刺激することにより、p40mRNAの発現は誘導されないが、p35mRNAは抗I-A抗体濃度依存的に発現が誘導される。また、抗I-A抗体刺激によりp35mRNAの発現誘導が起きているのはIL-12産生細胞のM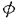 /DCである。 /DCである。 6)CD154-CHOにより刺激されたM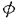 /DCはp40mRNA発現が誘導されるものの、IL-12は産生しない。これにさらに抗I-A抗体(28-16-8S)刺激が加わることによりp35mRNA発現が誘導され、その結果IL-12が産生される。 /DCはp40mRNA発現が誘導されるものの、IL-12は産生しない。これにさらに抗I-A抗体(28-16-8S)刺激が加わることによりp35mRNA発現が誘導され、その結果IL-12が産生される。 7)活性化固定35-9D(CD154+)で刺激されたM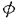 /DCではp40mRNA発現は誘導されるが、IL-12は産生しない。この系にOVAを添加することによりp35mRNAの発現も誘導され、その結果IL-12が産生される。また、さらに抗I-A抗体(M5/114)添加によりp35mRNA発現誘導が抑えられ、IL-12も産生きれなくなる。 /DCではp40mRNA発現は誘導されるが、IL-12は産生しない。この系にOVAを添加することによりp35mRNAの発現も誘導され、その結果IL-12が産生される。また、さらに抗I-A抗体(M5/114)添加によりp35mRNA発現誘導が抑えられ、IL-12も産生きれなくなる。 以上の結果から、Th細胞-APC相互反応において以下に挙げるメカニズムによりIL-12が産生されると考えられる。まず、APCがMHCclassII/AgによりTh細胞に抗原提示してTh細胞を活性化し、Th細胞上にCD154の発現を誘導する。このとき同時にMHC classIIを介してAPCが刺激され、p35の発現を誘導する。次に、APC上のCD40とTh細胞上に発現誘導されたCD154が相互反応することにより、APCにおいてP40の発現が誘導される。そして、p35とp40がジスルフィド結合してIL-12p70としてAPCから産生される。 IL-12刺激の受け手であるIL-12Rは、IL-12R 1鎖( 1鎖( 1)とIL-12R 1)とIL-12R 2鎖( 2鎖( 2)の少なくとも2本鎖によって複合体を形成していると考えられている。我々の研究部では、ナイーブCD4+T細胞を抗CD3抗体で刺激した際に、B7-2(CD86)による副刺激が特に 2)の少なくとも2本鎖によって複合体を形成していると考えられている。我々の研究部では、ナイーブCD4+T細胞を抗CD3抗体で刺激した際に、B7-2(CD86)による副刺激が特に 2mRNAの発現誘導に必須であることを明らかにした。CD86による副刺激の受け手として、CD4+T細胞にはCD28とCTLA-4(CD152)があり、CD4+T細胞の増殖反応やサイトカイン産生において、CD28副刺激は促進的に、一方CD152副刺激は抑制的に作用すると報告されている。そこで私は、CD28及びCD152副刺激により、ナイーブCD4+T細胞におけるIL-12R発現がいかなる制御を受けているかを解明することを目的として研究を行った。また、IL-12Rの発現を促進すると報告されているIFN- 2mRNAの発現誘導に必須であることを明らかにした。CD86による副刺激の受け手として、CD4+T細胞にはCD28とCTLA-4(CD152)があり、CD4+T細胞の増殖反応やサイトカイン産生において、CD28副刺激は促進的に、一方CD152副刺激は抑制的に作用すると報告されている。そこで私は、CD28及びCD152副刺激により、ナイーブCD4+T細胞におけるIL-12R発現がいかなる制御を受けているかを解明することを目的として研究を行った。また、IL-12Rの発現を促進すると報告されているIFN-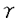 の関与についても検討を行った。その結果、以下のことが明らかになった。 の関与についても検討を行った。その結果、以下のことが明らかになった。 1)固相化抗CD3抗体刺激されたナイーブCD4+T細胞における 1、 1、 2mRNA発現、及びIL-12R複合体発現の誘導には、CD86による副刺激が必須である。 2mRNA発現、及びIL-12R複合体発現の誘導には、CD86による副刺激が必須である。 2)ナイーブCD4+T細胞を固相化抗CD3抗体とCD86-CHOで刺激する系に、抗CD28Fab抗体添加によりCD86-CD28相互反応を阻害すると、 1、 1、 2mRNA発現、及びIL-12R複合体発現が完全に抑制されるのに対し、抗CD152Fab抗体添加によりCD86-CD152相互反応を阻害すると、両mRNA発現、及びIL-12R複合体発現が増強される。 2mRNA発現、及びIL-12R複合体発現が完全に抑制されるのに対し、抗CD152Fab抗体添加によりCD86-CD152相互反応を阻害すると、両mRNA発現、及びIL-12R複合体発現が増強される。 3)ナイーブCD4+T細胞を固相化抗CD3抗体と固相化抗CD28抗体で刺激すると、 1、 1、 2mRNA発現、及びIL-12R複合体発現が誘導される一方、固相化抗CD3抗体と固相化抗CD152抗体で刺激した場合には、両mRNA発現、IL-12R複合体発現ともに誘導されない。 2mRNA発現、及びIL-12R複合体発現が誘導される一方、固相化抗CD3抗体と固相化抗CD152抗体で刺激した場合には、両mRNA発現、IL-12R複合体発現ともに誘導されない。 4)ナイーブCD4+T細胞を固相化抗CD3抗体と固相化抗CD28抗体で刺激する系に、さらに固相化抗CD152抗体による刺激を加えると、抗CD152抗体濃度依存的に 1、 1、 2mRNA発現、及びIL-12R複合体発現が抑制される。 2mRNA発現、及びIL-12R複合体発現が抑制される。 5)ナイーブCD4+T細胞を固相化抗CD3抗体とCD86-CHOで刺激する系に抗IFN-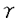 抗体を添加しても、 抗体を添加しても、 1、 1、 2mRNA発現、及びIL-12R複合体発現は完全には抑制されない。 2mRNA発現、及びIL-12R複合体発現は完全には抑制されない。 6)IFN-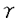 遺伝子欠損(IFN- 遺伝子欠損(IFN-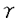 -/-)マウス由来のナイーブCD4+T細胞を固相化抗CD3抗体とCD86-CHOで刺激すると、野生型マウス(WT)由来のナイーブCD4+T細胞を刺激した場合と比してやや低下しているものの、IL-12R複合体発現が誘導される。また、この系に抗CD28Fab抗体または抗CD152Fab抗体を添加すると、2)での結果と同様、抗CD28Fab抗体により -/-)マウス由来のナイーブCD4+T細胞を固相化抗CD3抗体とCD86-CHOで刺激すると、野生型マウス(WT)由来のナイーブCD4+T細胞を刺激した場合と比してやや低下しているものの、IL-12R複合体発現が誘導される。また、この系に抗CD28Fab抗体または抗CD152Fab抗体を添加すると、2)での結果と同様、抗CD28Fab抗体により 1、 1、 2mRNA発現、及びIL-12R複合体発現は完全に抑制される一方、抗CDl52Fab抗体により両mRNA発現、及びIL-12R複合体発現は増強される。さらに、リコンビナントIFN- 2mRNA発現、及びIL-12R複合体発現は完全に抑制される一方、抗CDl52Fab抗体により両mRNA発現、及びIL-12R複合体発現は増強される。さらに、リコンビナントIFN-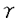 (rIFN- (rIFN-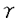 )による )による 1、 1、 2mRNA発現、及びIL-12R複合体発現の増強効果は、抗CD152Fab抗体存在下においてのみ認められる。 2mRNA発現、及びIL-12R複合体発現の増強効果は、抗CD152Fab抗体存在下においてのみ認められる。 7)IFN-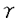 -/- ナイーブCD4+T細胞を抗CD152Fab抗体存在下に固相化抗CD3抗体とCD86-CHOで刺激して、IFN- -/- ナイーブCD4+T細胞を抗CD152Fab抗体存在下に固相化抗CD3抗体とCD86-CHOで刺激して、IFN-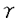 R R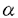 鎖及びIFN- 鎖及びIFN-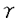 R R 鎖の発現をFACScanにて調べると、シグナル伝達を担うIFN- 鎖の発現をFACScanにて調べると、シグナル伝達を担うIFN-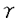 R R 鎖発現の有意な増強が認められる一方、IFN- 鎖発現の有意な増強が認められる一方、IFN-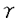 との結合能を有するIFN- との結合能を有するIFN-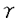 R R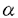 鎖発現には有意差は認められない。 鎖発現には有意差は認められない。 以上の結果をまとめると、ナイーブCD4+T細胞におけるIL-12Rの発現は、CD28/CD152副刺激、及びIFN-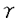 によって以下に示すような機構で調節されていると考えられる。 によって以下に示すような機構で調節されていると考えられる。 1)CD86によるCD28への副刺激はIL-12Rの発現誘導に不可欠である。また、CD28副刺激により産生増強されたIFN-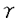 は、IL-12Rの発現を促進する。 は、IL-12Rの発現を促進する。 2)CD28副刺激によりIFN-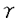 R R 鎖の発現が増強された結果、IFN- 鎖の発現が増強された結果、IFN-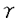 に対する反応性が増し、IFN- に対する反応性が増し、IFN-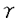 によるIL-12Rの発現が促進される。 によるIL-12Rの発現が促進される。 3)CD86によるCD152への副刺激は、CD28副刺激により誘導されたIL-12Rの発現を直接的に抑制するだけでなく、CD28副刺激により増強されたIFN-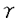 R R 鎖の発現を抑制することにより、IFN- 鎖の発現を抑制することにより、IFN-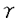 により促進されるIL-12R発現を間接的に抑えている。 により促進されるIL-12R発現を間接的に抑えている。 |