1907年に、初老期に進行性の記憶障害と知能低下を呈する新たな疾患が報告された。その後、この疾患はその報告者の名からアルツハイマー病(Alzheimer’s disease,AD)と呼ばれた。ADは病理学的には脳以外の臓器には変化がないとされている。脳における肉眼的な変化は、大脳皮質は全体に萎縮し、顕著な脳溝および脳室の拡大が存在する。顕微2鏡下においては、皮質全体にわたって老人斑および神経原線維変化と呼ばれるADの二大特徴が観察される。 ADは家族歴のある家族性ADと家族歴がない孤発性ADとが知られており、またこれらはそれぞれ発症年齢で65歳を境に、早発型と遅発型に大別されている。大多数のADを占める孤発性AD、あるいは家族性の遅発型ADについては複数の遺伝学的な危険因子が関与する多因子遺伝病ではないかと考えられている。ADの強力な危険因子としてアポリポプロテインE(アポE)の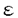 4アリルが知られている。しかし、 4アリルが知られている。しかし、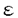 4アリルを持たないにもかかわらず発症する例も多数存在ることから、AD発症に際しては 4アリルを持たないにもかかわらず発症する例も多数存在ることから、AD発症に際しては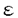 4アリル以外の他の複数の危険因子が作用していると考えられる。 4アリル以外の他の複数の危険因子が作用していると考えられる。 最近、ADに鉄が関与していることを示唆する論文がいくつか報告された。AD患者の大脳皮質では鉄が増加する傾向があることや(Ehmann et al.,1986)、ADの病理学的な特徴である神経原線維変化や老人斑に鉄の沈着が認められたこと(Connor et al.,1992;Smith et al.,1997)、そして鉄イオンのレベルが、老人斑の形成の原因となるAPP代謝に影響を与えていることなどが報告された(Bodovitz et al.,1995)。さらにImagwaらは、AD患者に鉄剤を投与することによってADの進行が抑制される場合があることを報告した(Imagawa et al.,1992)。これらの報告から、鉄がADの発症に何らかの影響を与えている可能性があると考えられる。 さらに、最近ADとトランスフェリンの関係を示唆する報告がいくつかある。Connorらにより、老人斑が抗トランスフェリン抗体で染色されることが報告され(Connor et al.,1992)、老人斑にトランスフェリンが蓄積していることが示唆された。さらにAD患者の脳の一部ではトランスフェリン量が低下していることも報告されている(Connor et al.,1992)。これらと先に述べたADと鉄の関係を併せて考えると、何らかの原因によるトランスフェリンが関与する鉄代謝異常がAD発症の一因を担っている可能性が考えられる。また、トランスフェリンのC2型はC1型と比べて、鉄結合能が低下していることが報告された(Wong and Saha,1986)。これらのことからわれわれは、トランスフェリンの多型が、AD発症の危険因子となっている可能性があるのではないがと考えた。 本研究では、C1アリルとC2アリルの塩基配列上の置換を初めて明らかにし、この塩基置換にもとずいたPCRとrestriction fragment length polymorphism(RFLP)によるトランスフェリンの遺伝子型決定法を新たに開発した。この方法を用いてC2のアリル出現頻度をAD患者との非AD患者について比較し、C2アリルがADの危険因子であるか否かを検討した。 1.コドン570のミスセンス変異がトランスフェリンのC1型とC2型を決定する トランスフエリンのC1型とC2型の一次構造上の違いを調べるため、等電点電位泳動によってトランスフエリンの表現型を決定した。等電点電位泳動上でC1/C1とC2/C2の表現型を示す血液サンプルから、ゲノムDNAを抽出し、いくつかのエクソンにおいてsingle strand conformation polymorphism(SSCP)解析を行った。その結果、エクソン15にSSCP陽性シグナルを検出した。エクソン15の塩基配列を解析したところ、コドン570(CCT)の最初の塩基に置換(C->T)があることが分かった。これにより、C1型の570番のプロリンが、C2型ではセリンに置換されていることが分かった。 P570Sのアミノ酸置換のみがC1型とC2型を決定していることを確かめるため、C1ホモ接合体とC2ホモ接合体のcDNAの全塩基配列を比較した。コーディシグ全領域の塩基配列を決定したが、コドン570のC/Tの塩基置換以外の配列はC1型とC2型の間で完全に一致していた。この結果は、P570Sのアミノ酸置換がヒトトランスフェリンのC1型とC2型を決定し、トランスフェリンの多型性はトランスフェリン遺伝子座の複対立遺伝子に起因することを示す。 2.PCRとRFLPによるC1とC2の遺伝子型決定法の確立 検出されたC1型とC2型の塩基置換部位にはいずれもあらゆる制限酵素切断部位が存在しなかったので、ミスマッチドプライマーを用いて遺伝子型を決定する方法を試みた。C1アリルが増幅された場合には新たに制限酵素BstEIIの切断部位が形成されるように、ライマー中の19番目の塩基AをTに変換した特殊なミスマッチドプライマーを設計した。このプライマーを用いてPCRを行うと、C1アリルを増幅した場合には制限酵素BstEIIの切断部位が形成されるが、C2アリルの増幅産物では切断部位が形成されない。つまり、これらのプライマーを用いたPCR産物を制限酵素BstEllで切断することによって、C1アリルとC2アリルを区別することが可能となる。 この遺伝子型決定法の信頼性を確かめるため、等電点電気泳動法で決定したトランスフェリンの表現型とPCRとRFLPにより決定した遺伝子型の結果を比較した。AD患者178人および年齢対応の年齢対応の非AD患者289人において検討したところ完全に一致した。 3.AD患者群および年齢対応の非AD患者群におけるトランスフェリンおよびアポEの遺伝子型の出現頻度 年齢対応の非AD患者群におけるトランスフェリンおよびアポEの遺伝子型が、ハーディ・ワインベルグの法則に従うか否かを最初に検討した。検定の結果、トランスフェリンおよびアポEともにハーディ・ワインベルグの法則によく従っていた。これは本研究に用いたサンプルのトランスフェリンおよびアポEの遺伝子型の分布が一様であることを示す。 AD患者群および年齢対応の非AD患者群におけるアポE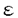 2、 2、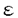 3、 3、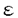 4アリルの出現頻度を調べたところ、すでに報告されている値によく合致していた。つまり、本研究のAD患者群および年齢対応の非AD患者群は、日本人におけるAD患者群および年齢対応の非AD患者群の集団として適当であることを確認した。 4アリルの出現頻度を調べたところ、すでに報告されている値によく合致していた。つまり、本研究のAD患者群および年齢対応の非AD患者群は、日本人におけるAD患者群および年齢対応の非AD患者群の集団として適当であることを確認した。 4.遅発型ADにおける危険因子としてのC2アリル 本研究おいて、AD患者ではC2アリルの出現頻度が年齢対応の非AD患者群に比べ有意に高かった(p<0.04)。次にAD患者を早発型と遅発型に分類したところ、遅発型においてC2アリルを有する患者の相対危険度が有意に高い値を示した(相対危険度;1.7、95%信頼区間;1.2-2.6,p<0.005)。一方、早発型ではそのような有意性は認められなかった。 5.アポEの遺伝子型とC2アリルの関係 われわれは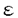 4アリルのコピー数とトランスフェリンC2アリルの出現頻度が相関するかどうかを検討した。 4アリルのコピー数とトランスフェリンC2アリルの出現頻度が相関するかどうかを検討した。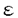 4アリルを0コピーもしくは1コピー持つ患者ではどちらも、AD患者のC2アリルの出現頻度は年齢対応の非AD患者にくらべ有意な差は認められなかった。一方、AD患者の 4アリルを0コピーもしくは1コピー持つ患者ではどちらも、AD患者のC2アリルの出現頻度は年齢対応の非AD患者にくらべ有意な差は認められなかった。一方、AD患者の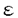 4アリルを2コピー持つ患者では、C2アリルの出現頻度が高く、0.50であった。この値は 4アリルを2コピー持つ患者では、C2アリルの出現頻度が高く、0.50であった。この値は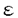 4アリルを0コピー(p<0.0003)もしくは1コピー(p<0.0004)有するAD患者群と比較しても有意に高かった。このAD患者の 4アリルを0コピー(p<0.0003)もしくは1コピー(p<0.0004)有するAD患者群と比較しても有意に高かった。このAD患者の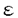 4アリルホモ接合体にみられたC2アリルの高い出現率は、早発型(0.45)と遅発型(0.53)ADの両群に認められた。 4アリルホモ接合体にみられたC2アリルの高い出現率は、早発型(0.45)と遅発型(0.53)ADの両群に認められた。 結論 1.トランスフェリンのC1アリルとC2アリルの間には、コドン570(CCT)の最初の塩基に置換(C->T)があることが分かった。これにより、C1型の570番のプロリンが、C2型ではセリンに置換される。 2.ミスマッチドプライマーを用いたPCRとRFLPを用いて、C1アリルとC2アリルの遺伝子型を決定する方法を開発した。 3.本研究に用いたサンプルはランダムに抽出された集団であり、日本人におけるAD患者群および年齢対応の非AD患者群の集団として適当であったことを確認した。 4.AD患者ではC2アリルの出現頻度が年齢対応の非AD患者群に比べ有意に高かった。また、遅発型ではC2アリルを有する患者の相対危険度が有意に高かった。 5.AD患者の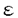 4アリルを2コピー持つ患者では、 4アリルを2コピー持つ患者では、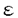 4アリルを0コピーもしくは1コピー有するAD患者群と比較してC2アリルの出現頻度が約2倍高かった。 4アリルを0コピーもしくは1コピー有するAD患者群と比較してC2アリルの出現頻度が約2倍高かった。 |