| 内容要旨 | | 背景 インスリン受容体はインスリン刺激により活性化されるチロシンキナーゼで,数種類の細胞内基質をリン酸化する。インスリン受容体基質であるinsulin receptor substrate(IRS)蛋白やGrb2-associated binder-1(Gab1)は,インスリン受容体によってチロシンリン酸化され,ホスファチジルイノシトール3(PI3)-キナーゼの活性化を引き起こし,細胞の糖取り込みなどのインスリン情報伝達系に関与していると考えられる。 IRS蛋白はこれまでにIRS-1/2/3/4がクローニングされており、いずれもN端部分にPH及びPTBドメインを持ち,アミノ酸配列上これらは似た構造を取っている。インスリン受容体がインスリン刺激で自己リン酸化されるとその受容体のリン酸化チロシンをIRS蛋白のPTBドメインが認識して受容体に直接結合し,その結果インスリン受容体のチロシンキナーゼにIRS蛋白はリン酸化される。IRS蛋白のリン酸化チロシンをPI3-キナーゼ調節サブユニットのSrc homology2(SH2)ドメインが認識して結合することでPI3-キナーゼが活性化し、糖取り込みなどへのシグナルを伝達すると考えられている。 Gab1は,インスリン刺激によってリン酸化されるインスリン受容体基質で,PI3-キナーゼを活性化することが知られているが,その糖代謝における役割についての詳細は不明である。また,Gab1は構造上他のIRS蛋白と相同性のあるPHドメインをもつが,PTBドメインをもたず,インスリン受容体に直接結合しないことからそのリン酸化機序は不明である。そこで本研究では,Gab1のインスリン情報伝達系における役割とそのインスリン受容体によるリン酸化機序について検討した。 方法1.抗体の作製 Gab1のN末端部分の21アミノ酸(MSGGEVVCSGWLRKSPPEKKL)の合成ペブチドを抗原にしてrabbit polyclonal抗体を作製した。 2.細胞 3T3-L1細胞はDME培地(10%成牛血清)の中でほぼconfluentに培養した後,分化培地にて48時間培養して脂肪細胞に分化させ,その後はDME培地(10%ウシ胎児血清)にて培養して使用した。インスリン刺激は10‐7Mにて10分間行った。 Sf9細胞はTC-100培地(10%ウシ胎児血清)の中で浮遊状態で培養したものを適当な培養ディッシュに移し,細胞が底面に付着したところでバキュロウイルスに感染させた。 3.Sf9細胞における各種蛋白の発現 IRS-1,Gab1,IR,EGFR,NGFR,HA tagつけた5種類のPI3-キナーゼ調節サブユニット(p85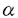 ,p85 ,p85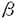 ,p55 ,p55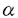 ,p55 ,p55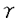 ,p50 ,p50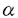 )など各種cDNAをpBacPAK8/9(Clontech)に挿入しマニュアル通りにこれらを組み込んだbaculovirusを作製した。baculovirusを感染させたSf9細胞は48時間後に回収して,免疫沈降およびウエスタンブロッティングに使用した。 )など各種cDNAをpBacPAK8/9(Clontech)に挿入しマニュアル通りにこれらを組み込んだbaculovirusを作製した。baculovirusを感染させたSf9細胞は48時間後に回収して,免疫沈降およびウエスタンブロッティングに使用した。 4.アデノウイルスを用いた調節サブユニットの培養細胞への発現 IRS-1,Gab1,HA tagつけたPI3キナーゼ調節サブユニットp85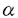 ,PI3-キナーゼの活性サブユニットとの結合部位を欠如したdominant negative p85 ,PI3-キナーゼの活性サブユニットとの結合部位を欠如したdominant negative p85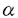 (DNp85 (DNp85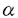 ),のcDNAをpA dexlwtのSwaI siteに挿入し,これらを組み込んだアデノウイルスを従来のマニュアルに従って作製した。これらを3T3-L1細胞等に感染させて過剰発現させ,48時間後に回収し,免疫沈降およびウエスタンブロッティングに使用した。 ),のcDNAをpA dexlwtのSwaI siteに挿入し,これらを組み込んだアデノウイルスを従来のマニュアルに従って作製した。これらを3T3-L1細胞等に感染させて過剰発現させ,48時間後に回収し,免疫沈降およびウエスタンブロッティングに使用した。 5.ウエスタンブロッティング Sf9及び3T3-L1細胞はlysis bufferに溶解後,免疫沈降,SDS-PAGE,nitrocelluloseシートへのtransfer後,適当な抗体でブロットしてECLにて蛋白を検出した。 結果 3T3-L1細胞をインスリン刺激するとIRS-1を介するPI3-キナーゼ活性が上昇し,糖取り込みも上昇した。IRS-1を過剰発現すると,刺激なしでのPI3-キナーゼ活性や糖取り込みは変化が見られなかったが,インスリン刺激でPI3-キナーゼや糖取り込み能が過剰発現させた蛋白量に応じてさらに上昇した。これに対して,Gab1を過剰発現させた場合には,Gab1を介するPI3-キナーゼ活性及び糖取り込み能がインスリン刺激なしですでに上昇しており,インスリン刺激にてそれがさらに上昇した。 次にGab1とPI3-キナーゼ調節サブユニットとの結合について調べた。Sf9細胞にGab1とPI3-キナーゼ調節サブユニットを同時に発現させ,抗Gab1抗体で免疫沈降するとp50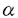 ,p55 ,p55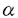 ,p55 ,p55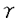 ,p85 ,p85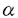 ,P85 ,P85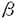 いずれの調節サブユニットもGab1と共沈した。この際,Gab1はリン酸化されていなかった。そこでPI3-キナーゼの調節サブユニットとGab1の結合部位について検討した結果、PI3-キナーゼの調節サブユニットのSH2ドメインにGab1がリン酸化チロシンを介さずに結合していることが分かった。Gab1についてはdeletion mutantを作成して調節サブユニットとの結合について検討し,c-Met binding domain(MBD)を欠失すると調節サブユニットとの結合能が失われる事が分かった。 いずれの調節サブユニットもGab1と共沈した。この際,Gab1はリン酸化されていなかった。そこでPI3-キナーゼの調節サブユニットとGab1の結合部位について検討した結果、PI3-キナーゼの調節サブユニットのSH2ドメインにGab1がリン酸化チロシンを介さずに結合していることが分かった。Gab1についてはdeletion mutantを作成して調節サブユニットとの結合について検討し,c-Met binding domain(MBD)を欠失すると調節サブユニットとの結合能が失われる事が分かった。 次にインスリン受容体による基質のリン酸化についての実験を行った。Sf9細胞でチロシンキナーゼ活性を持つインスリン受容体の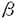 subunitとIRS-1の二者を同時に発現するとPTBドメインを持つIRS-1はチロシンリン酸化された。それに対し,PTBドメインを待たないGab1はインスリン受容体の subunitとIRS-1の二者を同時に発現するとPTBドメインを持つIRS-1はチロシンリン酸化された。それに対し,PTBドメインを待たないGab1はインスリン受容体の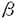 subunitと同時に発現させてもリン酸化されなかった。ところが,Gab1,インスリン受容体に加えて調節サブユニットを同時に発現するとGablはリン酸化された。 subunitと同時に発現させてもリン酸化されなかった。ところが,Gab1,インスリン受容体に加えて調節サブユニットを同時に発現するとGablはリン酸化された。 インスリン受容体と同様に受容体チロシンキナーゼであるEGF受容体,NGF受容体によるGab1のリン酸化についても検討した。Sf9細胞における過剰発現の系で,それそれの受容体とGab1二者の過剰発現ではGab1はリン酸化されなかった。しかし,Gab1,受容体に加えて調節サブユニットの三者を同時に発現させるとGab1はリン酸化された。 更にmammalian cellにおけるGab1のリン酸化についての実験を行った。3T3-L1細胞をインスリンで,EGF受容体を発現させたchinese hamster ovary(CHO)細胞をEGFで,NGF受容体をもつPC12細胞をNGFでそれぞれ刺激するとGab1がリン酸化されることが確認された。そこでこれらの細胞にp85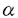 調節サブユニットをアデノウイルスベクターを用いて過剰発現させるとそれぞれの刺激によるGab1のリン酸化が増強された。またPI3-キナーゼ活性サブユニットとの結合部位を欠如したdominant negative(DN)p85 調節サブユニットをアデノウイルスベクターを用いて過剰発現させるとそれぞれの刺激によるGab1のリン酸化が増強された。またPI3-キナーゼ活性サブユニットとの結合部位を欠如したdominant negative(DN)p85 の過剰発現によっても同様の結果がみられた。 の過剰発現によっても同様の結果がみられた。 考察 インスリン受容体基質であるGab1は他のIRS-1/2/3/4と同様にインスリン刺激によってリン酸化され,また3T3-L1脂肪細胞における過剰発現によりGab1を介するPI3-キナーゼ活性や糖取り込み能が上昇することから,糖代謝に関与する蛋白である可能性が示唆された。しかし,Gab1はIRS蛋白と相同性はあるが,インスリン受容体との結合に必要とされるPTBドメインを持たないために,チロシンキナーゼであるインスリン受容体と直接結合することができず,そのリン酸化機序はIRS蛋白とは異なることが考えられた。 3T3-L1細胞でインスリン刺激なしのリン酸化されていないGab1を介するPI3-キナーゼの活性が認められたことから,Gab1とPI3-キナーゼ調節サブユニットが結合している可能性が示唆された。そこで,Sf9を用いてGab1と調節サブユニットの結合について検討した結果,Gab1のMBDと調節サブユニットのSH2ドメインが互いの結合に重要であり,これはリン酸化チロシンを介さないSH2ドメインとの結合であると考えられた。 Gab1のリン酸化機序については,インスリン受容体,Gab1,調節サブユニットの三者を同時に発現させることでGab1がリン酸化されるようになることから,インスリン刺激によって自己リン酸化したインスリン受容体のリン酸化チロシンに調節サブユニットがSH2ドメインを介して結合し,その結果すでに調節サブユニットに結合していたGab1がリン酸化される,というリン酸化機序が考えられた(図)。またこの調節サブユニットの役割はDNp85 においてもみられることから,PI3-キナーゼとしての作用とは独立の働きであると考えられた。 においてもみられることから,PI3-キナーゼとしての作用とは独立の働きであると考えられた。 これまでPI3-キナーゼ調節サブユニットのインスリンシグナル伝達における役割は,IRS-1/2/3/4などがチロシンリン酸化されるとSH2ドメインを介してそれらを認識して結合し,その結果PI3-キナーゼが活性化されてそれ以下のシグナルが伝達される事が知られていた。しかし本研究では,調節サブユニットがPI3-キナーゼ活性の調節とは独立な新たな役割があることが示唆された。すなわちインスリン受容体と直接結合できないGab1にチロシンリン酸化を介さず結合し,一方で活性化されたインスリン受容体キナーゼにも結合することによってGab1をリン酸化へと導くadaptorとしての役割である。このPI3-キナーゼの新たな機能はEGF受容体やNGF受容体など,調節サブユニットとの結合が知られている他の受容体型チロシンキナーゼによるGab1リン酸化においてもみられるものであった。 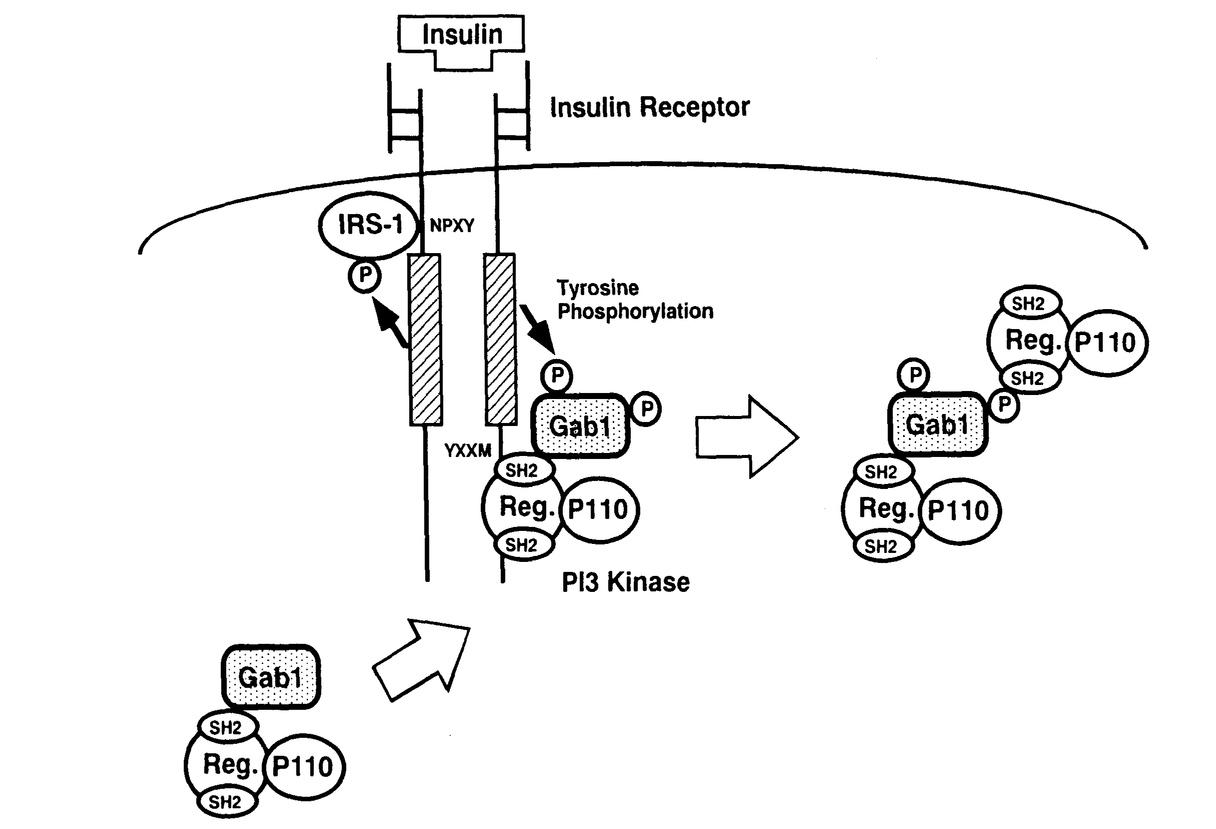 図表 図表 |
| 審査要旨 | | 本研究はインスリン受容体基質であるGab1について,3T3-L1細胞にアデノウイルスを,あるいはSf9細胞にバキュロウイルスを用いた蛋白の過剰発現の系にてGab1のインスリン情報伝達系における役割とその受容体によるリン酸化機構について検討したものであり,下記の結果を得ている。 1.3T3-L1細胞をインスリン刺激するとIRS-1を介するPI3-キナーゼ活性が上昇し,糖取り込みも上昇した。IRS-1を過剰発現すると,刺激なしでのPI3-キナーゼ活性や糖取り込みは変化が見られなかったが,インスリン刺激でPI3-キナーゼや糖取り込み能が過剰発現させた蛋白量に応じてさらに上昇した。これに対して,Gab1を過剰発現させた場合には,Gab1を介するPI3-キナーゼ活性及び糖取り込み能がインスリン刺激なしですでに上昇しており,インスリン刺激にてそれがさらに上昇した。このことからインスリン刺激なしでGab1がPI3-キナーゼと結合して活性を上昇させている可能性が示唆された。 2.Sf9細胞にGab1とPI3-キナーゼ調節サブユニットを同時に発現させ,抗Gab1抗体で免疫沈降するとp50 ,p55 ,p55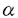 ,p55 ,p55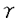 ,p85 ,p85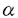 ,p85 ,p85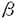 いずれの調節サブユニットもGab1と共沈した。この際,Gab1はリン酸化されていなかった。そこでPI3-キナーゼの調節サブユニットとGab1の結合部位について検討した結果、PI3-キナーゼの調節サブユニットのSH2ドメインにGab1がリン酸化チロシンを介さずに結合していることが分かった。Gab1についてはdeletion mutantを作成して調節サブユニットとの結合について検討し,c-Met binding domain(MBD)を欠失すると調節サブユニットとの結合能が失われる事が分かった。このことからGab1のMBDと調節サブユニットのSH2ドメインが結合に必要な部位であることが示唆された。 いずれの調節サブユニットもGab1と共沈した。この際,Gab1はリン酸化されていなかった。そこでPI3-キナーゼの調節サブユニットとGab1の結合部位について検討した結果、PI3-キナーゼの調節サブユニットのSH2ドメインにGab1がリン酸化チロシンを介さずに結合していることが分かった。Gab1についてはdeletion mutantを作成して調節サブユニットとの結合について検討し,c-Met binding domain(MBD)を欠失すると調節サブユニットとの結合能が失われる事が分かった。このことからGab1のMBDと調節サブユニットのSH2ドメインが結合に必要な部位であることが示唆された。 3.Sf9細胞でチロシンキナーゼ活性を持つインスリン受容体の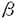 subunitとIRS-1の二者を同時に発現するとPTBドメインを持つIRS-1はチロシンリン酸化された。それに対し,PTBドメインを持たないGab1はインスリン受容体の subunitとIRS-1の二者を同時に発現するとPTBドメインを持つIRS-1はチロシンリン酸化された。それに対し,PTBドメインを持たないGab1はインスリン受容体の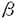 subunitと同時に発現させてもリン酸化されなかった。ところが,Gab1,インスリン受容体に加えて調節サブユニットを同時に発現するとGab1はリン酸化された。このことからGab1がPI3-キナーゼ調節サブユニットを介してインスリン受容体にリン酸化される可能性が示唆された。 subunitと同時に発現させてもリン酸化されなかった。ところが,Gab1,インスリン受容体に加えて調節サブユニットを同時に発現するとGab1はリン酸化された。このことからGab1がPI3-キナーゼ調節サブユニットを介してインスリン受容体にリン酸化される可能性が示唆された。 4.インスリン受容体と同様に受容体チロシンキナーゼであるEGF受容体,NGF受容体によるGab1のリン酸化についても検討した。Sf9細胞における過剰発現の系で,それぞれの受容体とGab1二者の過剰発現ではGab1はリン酸化されなかった。しかし,Gab1,受容体に加えて調節サブユニットの三者を同時に発現させるとGab1はリン酸化された。このことからインスリン受容体と同様にGab1がPI3-キナーゼ調節サブユニットを介してEGF受容体,NGF受容体にリン酸化されると考えられた。 5.3T3-L1細胞をインスリンで,EGF受容体を発現させたchinese hamster ovary(CHO)細胞をEGFで,NGF受容体をもつPC12細胞をNGFでそれぞれ刺激するとGab1がリン酸化されることが確認された。そこでこれらの細胞にp85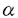 調節サブユニットをアデノウイルスベクターを用いて過剰発現させるとそれぞれの刺激によるGab1のリン酸化が増強された。またPI3-キナーゼ活性サブユニットとの結合部位を欠如したdominant negative(DN)p85 調節サブユニットをアデノウイルスベクターを用いて過剰発現させるとそれぞれの刺激によるGab1のリン酸化が増強された。またPI3-キナーゼ活性サブユニットとの結合部位を欠如したdominant negative(DN)p85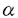 の過剰発現によっても同様の結果がみられた。このことからmammalian cellにおいてもGab1のリン酸化にPI3-キナーゼ調節サブユニットがキナーゼ活性とは独立して関与していることが示唆された。 の過剰発現によっても同様の結果がみられた。このことからmammalian cellにおいてもGab1のリン酸化にPI3-キナーゼ調節サブユニットがキナーゼ活性とは独立して関与していることが示唆された。 以上,本論文はインスリン情報伝達系においてGab1がPI3-キナーゼ活性及び糖取り込みを上昇させることを明らかにした。またこれまで不明とされていたGab1のインスリン受容体によるリン酸化機構を解明し,さらにはその機構がインスリン受容体に限らず他の受容体チロシンキナーゼであるEGF受容体,NGF受容体においても働く機構であることを示した。本研究は,インスリン及びEGF,NGFなど複数のシグナル情報伝達系の解明に重要な貢献をなすと考えられ,学位の授与に値するものと考えられる。 |