学位論文要旨
| No | 115405 | |
| 著者(漢字) | 迫田,秀之 | |
| 著者(英字) | Sakoda,Hideyuki | |
| 著者(カナ) | サコダ,ヒデユキ | |
| 標題(和) | 膜蛋白PC-1のインスリン抵抗性への関与 | |
| 標題(洋) | The Role of Membrane Glycoprotein Plasma Cell 1 on Insulin Resistance | |
| 報告番号 | 115405 | |
| 報告番号 | 甲15405 | |
| 学位授与日 | 2000.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第1591号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 内科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 2型糖尿病の原因として、インスリン分泌不全とインスリン抵抗性が大きな要因と考えられている。近年、インスリン抵抗性の強い糖尿病患者の皮膚線維芽細胞で、膜蛋白PC-1が増加していることが報告された。また、PC-1を過剰発現させた培養細胞では、インスリン受容体のチロシンリン酸化活性が低下しており、PC-1の増加によってインスリン抵抗性が生じるのではないかと考えられている。そこで、どうしてPC-1が増加するのかを調べるために、糖尿病モデル動物におけるPC-1の発現量を検討した。また、細胞内のインスリンシグナル伝達系に与える影響を調べるため、アデノウイルスを用いてPC-1を3T3-L1脂肪細胞に過剰発現させた系を用いて検討した。 1:ヒトとマウスの配列をもとに、degenerated PCR,RACE法を用いて、ラットPC-1のN端をクローニングした。ラットPC-1のN端のGST融合蛋白を合成し、これでウサギを免疫して、抗PC-1抗体を作製した。 2:糖尿病モデル動物として、1)過食による肥満、高インスリン血症を生じるZucker fattyラット、2)SDラットに2週間、脂肪分60%の高脂肪食負荷をした高脂肪食負荷ラット、3)SDラットにストレプトゾトシン(STZ)を腹腔内注射して、膵 3:各糖尿病モデル動物の、インスリン作用臓器である肝臓、骨格筋、脂肪組織より、RNase protection assay法でPC-1 mRNA量を、抗PC-1抗体を用いた免疫沈降物をWestern blotting法でPC-1蛋白発現量を測定した。 4:アデノウイルスベクターにヒトPC-1DNAを組込み、これを3T3-L1脂肪細胞に感染させて、PC-1を過剰発現させた。この系を用いて、インスリン刺激による、インスリン受容体、IRS-1(インスリン受容体の基質)のリン酸化、PI3-kinase活性、糖の取り込みを測定した。 degenerated PCR,RACE法を用いて、ラットPC-1のN端の775塩基をクローニングした。アミノ酸配列は、ヒトと87%(223/257)、マウスと94%(242/257)相同性があった。膜を貫通する21アミノ酸は、マウス、ラット、ヒト全てに保存されていた。 抗PC-1抗体の免疫沈降物をWestern blotting法で、正常のSDラットの各組織におけるPC-1蛋白発現量を測定した。PC-1は、これまでの報告通り、110kDaと220kDa dimerのバンドとして認識できた。肝、脂肪組織の発現量が多く、骨格筋、脳における発現量は少なく、インスリン作用組織とPC-1発現組織の間に関連はなかった。 Zucker fattyラットは、コントロールのZucker leanラットと比べ、血糖は正常だが、体重増加(272.3g:353.7g)と著明な高インスリン血症(187pM:1416pM)を生じた。2週間の60%高脂肪食負荷ラットは、空腹時血糖、体重はコントロールラットと同様だが、これまでの文献、当研究グループにおけるグルコースクランプ法などによる検討より、インスリン抵抗性を生じることが証明されている。STZラットは、インスリン欠乏(332pM:108pM)による高血糖(106mg/dl:493.8mg/dl)を生じた。 Zucker fattyラットの脂肪組織におけるPC-1 mRNAはコントロールに比べ190%に増加していた。蛋白発現量も150%に増加していた。しかし、肝、骨格筋におけるPC-1 mRNA、蛋白発現量は変化を認めなかった。 高脂肪食負荷ラットでは、PC-1 mRNAは、肝で78%、骨格筋で69%に減少していたが、蛋白レベルでは発現量の変化は認めなかった。脂肪組織のPC-1蛋白発現量も変化を認めなかった。 STZラットの肝、骨格筋では、PC-1 mRNA、蛋白発現量ともに有意な変化を認めなかった。 3T3-L1脂肪細胞に、アデノウイルスでPC-1を過剰発現させた細胞では、インスリン刺激によるインスリン受容体、IRS-1のチロシンリン酸化には、コントロールの細胞と比較して変化をみとめなかった。また、抗チロシンリン酸化抗体、抗IRS-1抗体による免疫沈降物中のPI3-kinase活性にも変化を認めなかった。インスリン刺激による、糖の取り込みもPC-1過剰発現によっての減少は認めなかった。 本研究では、糖尿病モデル動物と、PC-1を過剰発現させた培養細胞を用いて、膜蛋白PC-1のインスリン抵抗性への関与を検討した。 正常のSDラットでは、インスリン感受性臓器である肝、脂肪組織においてPC-1の発現量は多く、インスリンに反応しない脳や腎臓においてはPC-1の発現量は少なく、PC-1がインスリン抵抗性の原因となることは考えにくかった。また、異なる原因によりインスリン抵抗性を生じている糖尿病モデル動物においても、インスリン作用臓器におけるPC-1の発現量には変化を認めなかった。Zucker fattyラットの肪組織では、PC-1の増加を認めたが、3T3-L1脂肪細胞にPC-1を過剰発現しても、インスリン抵抗性は生じず、このことによってインスリン抵抗性を生じているとは考えられなかった。 Zucker fattyラットでは、脂肪組織の増殖が著明であり、PC-1の増加は、細胞の増加、肥大に関係するのではないかと考えられた。また、肥満のヒトの骨格筋でPC-1が増加しているとの報告があるが、肥満により骨格筋へ脂肪組織が浸潤し、PC-1が増加しているようにみえるのではないかと考えられた。 3T3-L1脂肪細胞に、アデノウイルスを用いてPC-1を過剰発現させた。正常のヒト皮下脂肪に比べ約16倍にPC-1の蛋白発現量を増やすことが出来たが、この条件下においても、インスリン刺激によるインスリン受容体のチロシンリン酸化の抑制はおこらず、その下流のIRS-1リン酸化、PI3-kinase活性、最終的な糖の取り込みといずれも変化を認めなかった。最初のPC-1の報告では、breast cancer由来の培養細胞を用いており、インスリンに対する感受性は低い細胞と考えられる。また、最近の報告で、CHO細胞とCHO-IR細胞にPC-1を過剰発現したところ、CHO細胞ではインスリン受容体のチロシンリン酸化の低下を認めたが、CHO-IR細胞では認めず、インスリン受容体の発現量が少ない時にPC-1によるインスリン受容体の抑制がおこるのではないかと考えられている。今回用いた3T3-L1脂肪細胞は、インスリン感受性が高く、生体内でインスリンの作用する、肝、骨格筋、脂肪における条件と近いものと考えられる。 したがって、3T3-L1脂肪細胞において、PC-1の増加はインスリン抵抗性の原因とはならず、また、糖尿病モデル動物においてもPC-1の発現量の変化を認めず、PC-1の発現量増加はインスリン抵抗性とは関係ないと考えられた。 | |
| 審査要旨 | 本研究は糖尿病の発症において重要な役割を演じているインスリン抵抗性について明らかにするために、インスリン抵抗性の強いヒトで増加している膜蛋白PC-1を、インスリン抵抗性モデル動物と、3T3-L1脂肪細胞にアデノウイルスでPC-1を過剰発現させた系で解析を試みたものであり、下記の結果を得ている。 1.degenerated PCR,RACE法を用いて、ラットPC-1のN端の775塩基をクローニングした。アミノ酸配列は、ヒトと87%(223/257)、マウスと94%(242/257)相同性があった。膜を貫通する21アミノ酸は、マウス、ラット、ヒト全てに保存されていることが示された。 2.正常のSDラットの各組織におけるPC-1蛋白発現量を測定した。PC-1は、これまでの報告通り、110kDaと220kDa dimerのバンドとして認識できた。肝、脂肪組織の発現量が多く、骨格筋、脳における発現量は少なく、インスリン作用組織とPC-1発現組織の間に関連はなかった。 3.インスリン抵抗性モデル動物の、Zucker fattyラット、高脂肪食負荷ラット、STZラットの肝、骨格筋、脂肪組織における、PC-1のmRNAと蛋白発現量を、それぞれRNase protection assay法、Western blotting法を用いて測定した。過食による肥満モデルであるZucker fattyラットの脂肪組織におけるPC-1 mRNAはコントロールに比べ190%に増加していた。蛋白発現量も150%に増加していた。しかし、肝、骨格筋におけるPC-1 mRNA、蛋白発現量は変化を認めなかった。2週間、脂肪分60%の高脂肪食負荷をした高脂肪食負荷ラットでは、PC-1 mRNAは、肝で78%、骨格筋で69%に減少していたが、蛋白レベルでは発現量の変化は認めなかった。脂肪組織のPC-1 mRNA、蛋白発現量も変化を認めなかった。SDラットにストレプトゾトシン(STZ)を腹腔内注射して、膵 4.3T3-L1脂肪細胞に、アデノウイルスでPC-1を過剰発現させた。正常のヒトの皮下脂肪に比べ約16倍にPC-1の発現量を増やすことに成功した。この系における、インスリン刺激によるインスリン受容体、IRS-1のチロシンリン酸化には、コントロールの細胞と比較して変化をみとめなかった。また、抗チロシンリン酸化抗体、抗IRS-1抗体による免疫沈降物中のPI3-kinase活性にも変化を認めなかった。インスリン刺激による、糖の取り込みもPC-1過剰発現によっての減少は認めなかった。 以上、本論文はインスリン抵抗性の原因と考えられていた膜蛋白PC-1について、インスリン抵抗性モデル動物とPC-1を過剰発現させた3T3-L1脂肪細胞を用いて、膜蛋白PC-1の増加によってはインスリン抵抗性は生じないことを明らかにした。本研究は、生活習慣の変化により増加傾向にある糖尿病の病因であるインスリン抵抗性に関して新しい知見を加えるものと考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54754 |
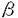 細胞を破壊したインスリン欠乏性モデルのSTZラットを用いた。
細胞を破壊したインスリン欠乏性モデルのSTZラットを用いた。