肝臓は、体内での中性脂肪合成において重要な臓器であり、食事などに由来する余剰の炭水化物を中性脂肪に変換する。高炭水化物食を実験動物に与えると、中性脂肪合成にかかわる諸酵素(アセチルCoAカルボキシラーゼ(ACC)、脂肪酸シンターゼ(FAS)、ステアリルCoAデサチュラーゼ(SCD)、ATP-クエン酸リアーゼ(ACL)、リンゴ酸酵素(ME)、グルコース-6-リン酸デヒドロゲナーゼ(G6PD)、ピルビン酸キナーゼ(PK)など)の合成が誘導される。この際の酵素の誘導は、主として転写活性化によるmRNAの増加に起因することも明らかにされている。 従来より多価不飽和脂肪酸には、肝臓における中性脂肪合成系諸酵素遺伝子の転写を抑制する作用のあることが知られていた。30年以上も前に、Allm annらは高炭水化物食に2%のリノール酸を添加すると、マウス肝臓におけるFASとG6PDの活性が70%低下することを見い出した。それに対し、パルミチン酸、オレイン酸やコレステロールの添加は中性脂肪合成を抑制しなかった。以来、多くの研究によって、n-6およびn-3系列の多価不飽和脂肪酸に肝臓での中性脂肪合成を抑制する作用のあることが明らかにされてきた。この抑制作用は、肝臓で、ACC、FAS、SCD、ACL、ME、G6PDやPKといった中性脂肪合成系の諸酵素をmRNAレベルで低下させることによることも判明していたが、そのメカニズムは不明のままであった。 Sterol regulatory element-binding proteins(SREBPs)は、basic-helix-loophelix-leucine zipper型の転写因子であり、コレステロール、脂肪酸、トリグリセリドの合成の調節を担っている。中でも、SREBP-1は、肝臓における中性脂肪合成系諸酵素の遺伝子発現調節に密接に関与していることが近年明らかになってきた。すなわち、絶食-再摂食の系や、トランスジェニックマウスでの検討により、肝臓の活性型SREBP-1c量と中性脂肪合成系諸酵素のmRNA量とがよく相関していることが示され、また、SREBP-1ノックアウトマウスの検討から、高炭水化物食による中性脂肪合成の促進が、主としてSREBP-1を介したものであることが判明した。 そこで我々は、本研究において、多価不飽和脂肪酸による中性脂肪合成系諸酵素遺伝子の発現抑制に、SREBP-1が関与している可能性について検討した。 まず始めに、野生型マウスに多価不飽和脂肪酸を摂食させ、肝臓における核内活性型SREBP-1タンパク質量の著明な低下を示した。次に、活性型SREBP-1トランスジェニックマウスにおいて、外来遺伝子による活性型SREBP-1の発現量の固定が、多価不飽和脂肪酸によるACC、FAS、SCD1、ACL、ME、G6PDやPKなどの中性脂肪合成系諸酵素のmRNA発現抑制を解消することを示した。この2つの実験結果より、多価不飽和脂肪酸による中性脂肪合成系諸酵素のmRNAの抑制がSREBP-1を介したものであることが証明された。また、多価不飽和脂肪酸によるSREBP-1の抑制は、主として、翻訳後調節によることが示され、膜結合型前駆体タンパク質の切断による活性化の段階で生じている可能性が強く示唆された。しかも、多価不飽和脂肪酸は核内活性型SREBP-2タンパク質量には影響を与えず、このSREBP-1の調節は、SREBP-2とは独立に行われることも明らかになった。 さらに、多価不飽和脂肪酸の作用機序につき検討を加えるために、PPAR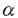 作動薬であるフェノフィブレートの、活性型SREBP-1タンパク質量への影響を検討した。多価不飽和脂肪酸はPPAR 作動薬であるフェノフィブレートの、活性型SREBP-1タンパク質量への影響を検討した。多価不飽和脂肪酸はPPAR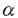 受容体のリガンドとなることが知られているが、PPAR 受容体のリガンドとなることが知られているが、PPAR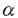 作動薬であるフェノフィブレートも、PPAR 作動薬であるフェノフィブレートも、PPAR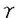 作動薬であるトログリタゾンも肝臓における活性型SREBP-1タンパク質量を減少させず、多価不飽和脂肪酸による活性型SREBP-1タンパク質量の抑制作用はPPAR 作動薬であるトログリタゾンも肝臓における活性型SREBP-1タンパク質量を減少させず、多価不飽和脂肪酸による活性型SREBP-1タンパク質量の抑制作用はPPAR 受容体を介したものではないことが示唆された。 受容体を介したものではないことが示唆された。 最後に、多価不飽和脂肪酸によるSREBP-1抑制状態と、SREBP-1ノックアウトマウスとを比較検討した。肝臓における中性脂肪合成系諸酵素の遺伝子発現量の低下や血中脂質濃度の低下に関して、この二つのモデルが極めて類似していることが判明し、SREBP-1が血中脂質値改善のための薬物療法のすぐれたターゲットとして位置付けられうる可能性が示唆された。 |