本研究は、強力な血管収縮物質であると同時に重要な細胞増殖因子であるアンジオテンシンII(AII)に着目し、高血圧による腎糸球体障害の発症・進展へのレニン・アンジオテンシン系の関与を明らかにするために、アンジオテンシンII type1a(AT1a)受容体遺伝子欠損マウスを用いてAT1a受容体の局在およびAIIの腎血行動態作用および非血行動態作用の検討を行い、下記の結果を得ている。 1.AT1a受容体遺伝子欠損マウスのヘテロ接合体の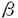 -galactosidaseの同定、および -galactosidaseの同定、および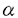 -平滑筋アクチンと平滑筋特異的ミオシンの免疫組織化学染色により輸入・輸出細動脈を同定し、腎微小循環におけるAT1a受容体の局在を検討した。AT1a受容体(= -平滑筋アクチンと平滑筋特異的ミオシンの免疫組織化学染色により輸入・輸出細動脈を同定し、腎微小循環におけるAT1a受容体の局在を検討した。AT1a受容体(=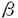 -galactosidase)は、輸入と輸出細動脈の両方の平滑筋細胞に発現していることが示された。また、糸球体及び糸球体外のメサンギウム細胞、JG細胞にも発現していることが確認された。 -galactosidase)は、輸入と輸出細動脈の両方の平滑筋細胞に発現していることが示された。また、糸球体及び糸球体外のメサンギウム細胞、JG細胞にも発現していることが確認された。 2.AT1a受容体遺伝子欠損マウス、ホモ接合体および野生型のマウスで水腎症を作製し、顕微鏡下で直接腎細動脈を観察できるようにし、exo vivoにおけるAIIの輸入細動脈と輸出細動脈への作用を検討した。野生型マウスでは、AIIに対して10-14Mから10-6Mまで用量依存性に輸入・輸出細動脈は収縮した。予めCV-11974(AT1a拮抗薬)の投与によりこの反応は抑制された。ホモ接合体では、輸入細動脈と輸出細動脈は両方とも著明に拡張しており、AII10-8M投与でどちらの細動脈も全く収縮しなかった。以上より、AIIが両方の細動脈に同等に作用することが示され、1のAT1a受容体の局在の結果と一致していた。また、AIIの細動脈への作用は、AT1a受容体を介していることが示された。 3.AT1a受容体遺伝子欠損マウスのヘテロ接合体、ホモ接合体マウスおよび野生型マウスで低レニン性高血圧モデルであるDOCA食塩高血圧を作製し、糸球体障害の進展における組織レニン・アンジオテンシン系の関与を検討した。その結果、ホモ接合体のDOCA食塩高血圧で最も血圧が上昇し、糸球体障害も強く、血圧の上昇の程度と糸球体障害の程度との間には相関が見られた(r=0.63)。従って、本低レニン性高血圧における糸球体障害には、組織レニン・アンジオテンシン系は関与せず、血圧に依存していることが示唆された。また、AT1を介するAIIの働きが欠損すると、食塩感受性が亢進することも示された。この機序としてAT1a受容体遺伝子欠損マウスでは近位尿細管でのNa排泄がもともと増加している状態にあるが、そこにさらに塩分を過剰に負荷すると処理能力を越え、Naが体内に著明に貯留し血圧が上昇すること、また、AIIのAT1a受容体を介する働きの欠落のため、Na負荷に対しさらに輸入細動脈が拡張することでNa利尿を達成することができないことが考えられた。 4.3で得られた結果をさらに確認するために、野生型マウスにACE阻害薬及びAT1受容体拮抗薬を投与しDOCA食塩高血圧モデルを作製し、Ca拮抗薬または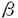 遮断薬を投与した場合と比較検討した。その結果、ACE阻害薬及びAT1受容体拮抗薬を投与した野生型マウスのDOCA食塩高血圧モデルで、Ca拮抗薬または 遮断薬を投与した場合と比較検討した。その結果、ACE阻害薬及びAT1受容体拮抗薬を投与した野生型マウスのDOCA食塩高血圧モデルで、Ca拮抗薬または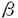 遮断薬を投与した場合よりも血圧は上昇し、高血圧による糸球体障害が増悪した。レニン・アンジオテンシン系を抑制することにより高血圧における食塩感受性が増大することが確認された。 遮断薬を投与した場合よりも血圧は上昇し、高血圧による糸球体障害が増悪した。レニン・アンジオテンシン系を抑制することにより高血圧における食塩感受性が増大することが確認された。 以上、本論文はAT1a受容体遺伝子欠損マウスを用いることにより、AT1a受容体が輸入細動脈と輸出細動脈の両方に発現し、AIIはAT1a受容体を介して両方の細動脈に同程度に作用し、糸球体血行動態を調節していることを明らかにした。また、レニン・アンジオテンシン系の欠損が食塩感受性を亢進させ、糸球体障害を増悪させることを示した。本研究は、従来いわれてきた「AIIが輸出細動脈への特異的な収縮作用」「ACE阻害薬やAT1受容体拮抗薬の腎保護作用」とは異なる新しい知見であり、AIIの腎血行動態作用や組織レニン・アンジオテンシン系の高血圧における役割の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |