本研究は、PGD2の新たなる作用や作用メカニズム、血管保護因子としての役割を解明する為に、PGD2合成酵素遺伝子(PGDS遺伝子)をelectroporation(EP)法にて血管平滑筋細胞、血管内皮細胞に導入し、内因性PGD2産生を刺激することにより、iNOSによるNO産生をはじめとする種々の血管障害因子への影響を検討したものであり、下記の結果を得ている。 (1) IL-1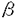 刺激により増加したVSMCでのNO産生は10-7〜10-5mol/Lの外因性PGD2、あるいは15-deoxy- 刺激により増加したVSMCでのNO産生は10-7〜10-5mol/Lの外因性PGD2、あるいは15-deoxy- 12,14PGJ2の添加により用量依存性に抑制された。抑制の程度は有意に15-deoxy- 12,14PGJ2の添加により用量依存性に抑制された。抑制の程度は有意に15-deoxy- 12,14PGJ2の方が強がった。 12,14PGJ2の方が強がった。 (2) EP法でPGDS遺伝子導入後、アラキドン酸を添加し、PGD2合成を刺激したところ、VSMCでの内因性PGD2産生は有意に増加した。 (3) IL-1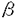 刺激によりPGDS遺伝子非導入VSMCでのNO産生は有意に増加したが、RGDS遺伝子導入後、アラキドン酸で刺激したVSMCではIL-1 刺激によりPGDS遺伝子非導入VSMCでのNO産生は有意に増加したが、RGDS遺伝子導入後、アラキドン酸で刺激したVSMCではIL-1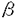 刺激によるNO産生量は有意に減少し、iNOS mRNA発現量、iNOS蛋白産生量とも有意に抑制された。 刺激によるNO産生量は有意に減少し、iNOS mRNA発現量、iNOS蛋白産生量とも有意に抑制された。 (4) PGDS遺伝子導入後、アラキドン酸で刺激した細胞では、細胞外に分泌されたPGD2を抗PGD2抗体で中和しても、IL-1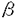 刺激によるNO産生量は有意に減少し、mRNA発現量も有意に抑制された。 刺激によるNO産生量は有意に減少し、mRNA発現量も有意に抑制された。 (5) PGDS遺伝子非導入ECでのPAI-1産生は、IL-1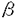 刺激により有意に増加したが、PGDS遺伝子導入後アラキドン酸刺激したECでは、IL-1 刺激により有意に増加したが、PGDS遺伝子導入後アラキドン酸刺激したECでは、IL-1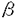 刺激によるPAI-1産生量は有意に減少し、PAI-1mRNA発現量も有意に抑制された。 刺激によるPAI-1産生量は有意に減少し、PAI-1mRNA発現量も有意に抑制された。 (6) PGDS遺伝子非導入ECでのET-1産生は、IL-1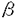 刺激により有意に増加したが、PGDS遺伝子導入後アラキドン酸で刺激したECでは、IL-1 刺激により有意に増加したが、PGDS遺伝子導入後アラキドン酸で刺激したECでは、IL-1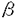 刺激によるET-1産生量は有意に減少した。 刺激によるET-1産生量は有意に減少した。 以上、本論文は新しい細胞内メカニズムを介した内因性PGD2の血管障害因子抑制作用を示した。これは、血管壁構成細胞における細胞内メカニズムを介した内因性PGD2の血管保護性作用を示すとともに、PGDS遺伝子導入によって血管障害を防御していくという新しい血管障害克服法の確立にむけて重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |