インスリン非依存性糖尿病は、食生活の欧米化及び運動量の低下というライフスタイルの変化に伴い、ここ数年増加傾向を示し、厚生省の報告では約700万人に達している。糖尿病患者における治療の最大の目的は合併症の予防である。糖尿病の合併症には、血管障害と神経障害がある。血管障害は、網膜症や腎症などの細小血管障害と虚血性心疾患や脳血管障害などの大血管障害の2つに分けられる。網膜症や腎症などの細小血管障害は、糖尿病の血糖コントロール状態や罹病期間と相関するが、虚血性心疾患や脳血管障害などの大血管障害の発症は、必ずしも血糖コントロール状態や罹病期間とは相関しないことが報告されている。しかし、多くの疫学調査が示すように、糖尿病患者では虚血性心疾患や脳血管障害の発症率は高く、この背景としてインスリン抵抗性が関与していると考えられており、インスリン抵抗性を改善することは、最も合理的な治療であると考えられる。 トログリタゾンは、インスリン抵抗性を改善させる新しい種類の糖尿病治療薬である。臨床成績や動物実験において、トログリタゾンは高血圧や高脂血症を改善するという報告やin vitroにおいて、血管平滑筋細胞の増殖を抑制するという報告もあり、トログリタゾン自身の抗動脈硬化作用もあると考えられる。 一方、血管内皮細胞は血管収縮因子や血管弛緩因子などを分泌し血管トーヌスの制御において重要な役割を果たす。特に血管内皮細胞より分泌されるエンドセリン-1(ET-1)は、強力な血管収縮因子であると同時に血管平滑筋細胞の増殖促進作用をもち、動脈硬化促進作用を有する。 このように高血圧の成因や動脈硬化の発症進展に深く関与していると考えられている血管内皮細胞に対するトログリタゾンの作用にについての検討は未だなされていない。そこで、本研究では、トログリタゾンの血管内皮細胞に対する影響、特にET-1分泌についてどのような影響を及ぼすかを検討した。 我々の実験系で、ウシ培養血管内皮細胞からET-1の分泌量がインスリン刺激にて濃度依存的に増加することを確認した。一方、トログリタゾンは、培養血管内皮細胞からのspontaneous及びインスリン刺激によるET-1分泌を濃度依存的及び時間依存的に抑制した。 血管内皮細胞からは、ET-1,血小板由来増殖因子等の血管収縮因子やプロスタサイクリン(PGI2)、一酸化窒素(NO)等の血管弛緩因子が分泌される。PGI2やNOは、培養血管内皮細胞からのET-1の分泌を抑制することが報告されている。PGI2合成阻害薬であるインドメサシンやNO合成酵素阻害薬を用いPGI2やNOの影響を除去した実験系において、トログリタゾンによる培養血管内皮細胞からのET-1分泌抑制作用は変化しなかった。この結果より、トログリタゾンによるET-1分泌抑制作用はPGI2やNOを介したautocrineによる間接的作用によるものではないと考えられる。更にノーザンブロット解析にてトログリタゾン刺激30分後という短時間よりET-1mRNAの発現が抑制されたことより、ET-1分泌抑制作用は、トログリタゾン自身の直接的作用と考えられる。 次にトログリタゾンのET-1分泌抑制作用の細胞内シグナル伝達系について検討した。トログリタゾンは、ET-1遺伝子転写因子活性を濃度依存的に抑制したことにより、このトログリタゾンのET-1分泌抑制作用は、転写レベルより上流で制御されていると考えられる。 ET-1分泌は、PKCの活性化や細胞内Caイオン濃度の上昇により、ET-1の分泌が促進されることが知られている。これに反して、インスリンのET-1分泌促進作用はPKCや細胞内Caイオンを介していない。アンジオテンシンIIは、PKCの活性化や細胞内Caイオン濃度の上昇を介してET-1の分泌を促進する。チアゾリジン系薬剤は、細胞内Caイオン濃度の抑制を介して血管平滑筋細胞の弛緩作用を示し、降圧効果に関与していることが報告された。トログリタゾンのウシ培養血管内皮細胞からのET-1分泌抑制作用に細胞内Caイオン濃度が関与しているかを検討した。アンジオテンシンIIにより上昇した細胞内Caイオン濃度は、トログリタゾンにより影響を受けなかった。次にこのET-1分泌抑制作用がPKCを介しているかどうかを検討した。高濃度TPAで長時間preincubateし、PKCを十分にdown regulationしたウシ培養血管内皮細胞においてもトログリタゾンのET-1分泌抑制作用がコントロールと同程度に認められた。これらの結果は、トログリタゾンのET-1分抑制泌作用は、PKCや細胞内Caイオン濃度を介していないことを示唆した。 トログリタゾン、ピオグリタゾンのチアゾリジン系薬剤や15d-PGJ2は、PPAR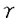 のリガンドとして知られている。PPAR のリガンドとして知られている。PPAR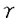 にはPPAR にはPPAR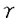 1とPPAR 1とPPAR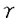 2の2つのアイソフォームがあり、alternate splicing isoformである。PPAR 2の2つのアイソフォームがあり、alternate splicing isoformである。PPAR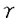 2は主に脂肪細胞に発現しており、脂肪細胞の分化誘導に関与している。一方、PPAR 2は主に脂肪細胞に発現しており、脂肪細胞の分化誘導に関与している。一方、PPAR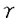 1は、種々の組織で発現しているが、その機能についてはすべて明らかにはなっていない。しかし、血管内皮細胞において、PPAR 1は、種々の組織で発現しているが、その機能についてはすべて明らかにはなっていない。しかし、血管内皮細胞において、PPAR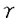 1が発現しているかは不明である。そこで、PPAR 1が発現しているかは不明である。そこで、PPAR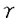 1に特異的なプライマーを用いてRT-PCR解析を行い、血管内皮細胞にPPAR 1に特異的なプライマーを用いてRT-PCR解析を行い、血管内皮細胞にPPAR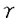 1 mRNAが発現しているのを確認した。トログリタゾンのET-1分泌抑制作用がPPAR 1 mRNAが発現しているのを確認した。トログリタゾンのET-1分泌抑制作用がPPAR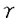 1を介しているかを検討するために、他のPPAR 1を介しているかを検討するために、他のPPAR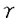 リガンドやPPAR リガンドやPPAR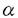 リガンドを用いてET-1分泌量を測定した。その結果、PPAR リガンドを用いてET-1分泌量を測定した。その結果、PPAR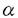 リガンドはET-1分泌に影響を及ぼさなかったが、ピオグリタゾンや15d-PGJ2のPPAR リガンドはET-1分泌に影響を及ぼさなかったが、ピオグリタゾンや15d-PGJ2のPPAR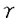 リガンドは、トログリタゾンと同じように培養血管内皮細胞からのET-1の分泌を抑制した。 リガンドは、トログリタゾンと同じように培養血管内皮細胞からのET-1の分泌を抑制した。 更にPPAR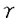 を過剰発現させることにより、トログリタゾンのウシ培養血管内皮細胞からのET-1分泌抑制作用が増強されるかどうか検討した。過剰発現させる方法として、PPAR を過剰発現させることにより、トログリタゾンのウシ培養血管内皮細胞からのET-1分泌抑制作用が増強されるかどうか検討した。過剰発現させる方法として、PPAR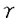 アデノウイルスを作製した。ウエスタンブロット解析により、作製したPPAR アデノウイルスを作製した。ウエスタンブロット解析により、作製したPPAR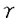 アデノウイルスがPPAR アデノウイルスがPPAR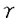 を発現していることを確認した。ウシ培養血管内皮細胞の全細胞にアデノウイルスをinfectionさせるためのウイルス量を検討した結果、500particle/cellのウイルス量が必要であった。500particle/cellのウイルス量のPPAR を発現していることを確認した。ウシ培養血管内皮細胞の全細胞にアデノウイルスをinfectionさせるためのウイルス量を検討した結果、500particle/cellのウイルス量が必要であった。500particle/cellのウイルス量のPPAR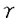 アデノウイルス及びLacZアデノウイルスをウシ培養血管内皮細胞にinfectionさせ、PPAR アデノウイルス及びLacZアデノウイルスをウシ培養血管内皮細胞にinfectionさせ、PPAR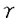 を過剰発現させたことにより、トログリタゾンによる培養血管内皮細胞からのET-1分泌抑制作用は増強した。これらの結果は、トログリタゾンのET-1分泌抑制作用はPPAR を過剰発現させたことにより、トログリタゾンによる培養血管内皮細胞からのET-1分泌抑制作用は増強した。これらの結果は、トログリタゾンのET-1分泌抑制作用はPPAR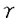 の活性を介していることを示唆すると考えられた。 の活性を介していることを示唆すると考えられた。 以上の結果より、トログリタゾンは、spontaneous及びインスリン刺激によるET-1分泌を抑制した。この作用機序は、PPAR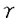 の活性化を介している可能性を示唆した。このトログリタゾンによるET-1分泌抑制作用は、トログリタゾンによる血圧改善の機序に関与し、さらにインスリン抵抗性が原因の心筋梗塞や脳梗塞などの合併症を予防する抗動脈硬化作用の可能性が考えられる。 の活性化を介している可能性を示唆した。このトログリタゾンによるET-1分泌抑制作用は、トログリタゾンによる血圧改善の機序に関与し、さらにインスリン抵抗性が原因の心筋梗塞や脳梗塞などの合併症を予防する抗動脈硬化作用の可能性が考えられる。 |