【目的】全身性エリテマトーデス(SLE)の一亜系として、血小板減少症、動静脈血栓症、習慣性流産、抗カルジオリピン抗体産生を症候とする抗リン脂質抗体症候群(APS)が知られている。雄(NZW x BXSB)F1マウスは、SLE合併抗リン脂質抗体症候群のモデルマウスとして広く使われている。本研究では、多遺伝子疾患であると考えられているAPSについて、雄NZWx(NZW x BXSB)退交配マウスを用いて、血小板減少症、血小板結合自己抗体、抗カルジオリピン抗体をマーカーとしたマイクロサテライトマーカー連鎖解析を行い、BXSB由来のAPS感受性遺伝子のマッピングと候補遺伝子の検索を行った。 【方法】退交配マウスは、雌NZWと雄(NZW x BXSB)F1を交配して生産し、SLE病態発症に促進効果を示す変異遺伝子Yaa(Y chromosome-linked autoimmune acccleration)を持つ雄マウスのみを研究に使用した。血小板数はフローサイトメトリーにて測定した。血小板結合自己抗体は、ヤギ抗マウス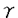 鎖抗体を用い、フローサイトメトリーにて全体の血小板数のうちIgG結合血小板の割合で表現した。抗カルジオリピン抗体は、ELISAにて測定した。BXSB、NZWマウスにおいて、組織プラスミノーゲンアクチベーター(t-PA)遺伝子Platの構造遺伝子とプロモーター領域、及びプラスミノーゲン遺伝子Plgの構造遺伝子の塩基配列を解読した。退交配マウスにおけるAPS症候と感受性遺伝子との連鎖解析はBXSBとNZW間で多型を示す108個のマイクロサテライトマーカーを用い解析した。連鎖解析には、Pearson’s 鎖抗体を用い、フローサイトメトリーにて全体の血小板数のうちIgG結合血小板の割合で表現した。抗カルジオリピン抗体は、ELISAにて測定した。BXSB、NZWマウスにおいて、組織プラスミノーゲンアクチベーター(t-PA)遺伝子Platの構造遺伝子とプロモーター領域、及びプラスミノーゲン遺伝子Plgの構造遺伝子の塩基配列を解読した。退交配マウスにおけるAPS症候と感受性遺伝子との連鎖解析はBXSBとNZW間で多型を示す108個のマイクロサテライトマーカーを用い解析した。連鎖解析には、Pearson’s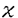 2検定を用い、症候の程度と感受性遺伝子の組み合わせによって分けたマウスグループ間の相関は、Student’s t検定とANOVA(analysis of variance)で解析した。 2検定を用い、症候の程度と感受性遺伝子の組み合わせによって分けたマウスグループ間の相関は、Student’s t検定とANOVA(analysis of variance)で解析した。 【結果】SLEに合併する二次性APSのマウスモデルである雄(NZW x BXSB)F1を用いて、代表的APS症候である血小板減少症、IgG血小板結合自己抗体、IgG抗カルジオリピン抗体を指標としたAPS感受性遺伝子の解析を試みた。一連の遺伝学的研究で先に、これらAPSの三症候は密接に関連した遺伝的要因によって発現しており、BXSB由来の遺伝子がその発症を規定し、NZW由来の遺伝子がその症候を増強的に修飾していること、また、これら遺伝的要因を支配するBXSB由来遺伝子のうち、第8および第17染色体に存在する2つの各々Pbat-2とPbat-1遺伝子が血小板減少症、血小板結合自己抗体の感受性遺伝子であり、主要なAPS感受性遺伝子であることが明らかにされていた。本研究でこれらの点を追試した結果、上記の事実に加え、新たに、抗カルジオリピン抗体もPbat-2に連鎖することが明らかになった。これら感受性遺伝子領域に連鎖して存在する既知遺伝子を検索したところ、Pbat-2の候補遺伝子としてt-PA遺伝子Platが、また、Pbat-1の候補遺伝子としてプラスミノーゲン遺伝子PlgあるいはMHC(マウスではH-2)連鎖遺伝子が推定された。これら遺伝子多型を調べたところ、Plat catalytic domainに存在するBXSB特有の多型が存在すること、またこのBXSB Plat多型の遺伝的解析で、これがPbat一1遺伝子と相補的にAPS発症に寄与しているAPS感受性遺伝子の一つである可能性が示された。一方、Plg構造遺伝子にはBXSBとNZWマウス間で多型は存在しないことから、Pbat-1遺伝子は多型MHC連鎖遺伝子である可能性が示唆された。 【考察】今回検索の対象としたAPSの三症候は、遺伝的解析により非常に高い相関を示す病的形質であり、共通の遺伝的要因が関与した症候であることが強く示唆された。このことは、各症候の感受性遺伝子mappingで裏付けられた。三症候のうち、抗カルジオリピン抗体の出現に関与する遺伝子座として第4,8,17染色体に存在する三つがmapされたが、このうちの第8及び第17染色体遺伝子座は他の二つの症候,すなわち血小板結合自己抗体と血小板減少症に関与する遺伝子座とほぼ同じ領域に存在するので、これらは三症候の発現に共通した遺伝子効果を示す感受性遺伝子である可能性が極めて高いと考えられた。この事はまた、APSに出現する血小板減少症の発症機構に抗カルジオリピン抗体や血小板結合自己抗体が深く関わっていることを示唆している。今回我々は、APS感受性遺伝子の一候補遺伝子としてPlatに注目し、その多型解析を行い新しい多型を見いだすとともに、この多型が血小板減少症やIgG血小板結合自己抗体と相関していることを示した。発見した多型で最も重要と考えられたのは、構造遺伝子領域の第1237番目塩基にあるGからAへの置換であり、t-PAのcatalytic domainで陰性荷電をもつGluから、陽性荷電をもつLysへの変換を伴った。この変換がプラスミノーゲンに対するt-PA活性の低下をもたらし、これに伴うプラスミン活性低下に由来する線溶系異常が血栓傾向を引き起こす可能性が考えられた。プラスミノーゲンからプラスミンへの転換異常は、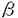 2GPIを含む血小板抗原への免疫反応の亢進をもたらしたり、破壊された血小板由来の 2GPIを含む血小板抗原への免疫反応の亢進をもたらしたり、破壊された血小板由来の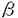 2GPIエピトープを効率的に抗原提示細胞に提示する要因ともなりうると考えられた。(NZW x BXSB)F1マウスにおける、血小板減少症とIgG血小板結合自己抗体は、第8染色体のPlatと連鎖するPbat-2とH-2複合体やプラスミノーゲン遺伝子Plgの連鎖するPbat-1との相補作用に統御されていた。このことについては、二つの解釈が可能であった。一つは、t-PAによるプラスミノーゲンのプラスミンへの転換は、t-PA、プラスミノーゲン、フィブリンの三量体形成下で起こることより、三量体中の多型t-PAと多型プラスミノーゲンとの相互作用異常がAPSの原因となっている可能性である。第二は、Pbat-1がH-2複合体クラスII遺伝子多型であり、 2GPIエピトープを効率的に抗原提示細胞に提示する要因ともなりうると考えられた。(NZW x BXSB)F1マウスにおける、血小板減少症とIgG血小板結合自己抗体は、第8染色体のPlatと連鎖するPbat-2とH-2複合体やプラスミノーゲン遺伝子Plgの連鎖するPbat-1との相補作用に統御されていた。このことについては、二つの解釈が可能であった。一つは、t-PAによるプラスミノーゲンのプラスミンへの転換は、t-PA、プラスミノーゲン、フィブリンの三量体形成下で起こることより、三量体中の多型t-PAと多型プラスミノーゲンとの相互作用異常がAPSの原因となっている可能性である。第二は、Pbat-1がH-2複合体クラスII遺伝子多型であり、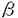 2GPIを含む血小板抗原に対する自己抗体の親和性成熟に関与している可能性である。検索したプラスミノーゲン構造遺伝子にBXSB と NZWマウス間で多型が存在しないこと、また、以前になされた(NZW x BXSB)F1のH-2コンジェニックマウスにおける研究結果とあわせ、現在第二の仮説がより可能性があると考えられた。仮説として、恐らくある特定のH-2クラスII分子に親和性を持つ 2GPIを含む血小板抗原に対する自己抗体の親和性成熟に関与している可能性である。検索したプラスミノーゲン構造遺伝子にBXSB と NZWマウス間で多型が存在しないこと、また、以前になされた(NZW x BXSB)F1のH-2コンジェニックマウスにおける研究結果とあわせ、現在第二の仮説がより可能性があると考えられた。仮説として、恐らくある特定のH-2クラスII分子に親和性を持つ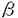 2GPIを含むであろう血小板抗原が、t-PA多型に由来する血小板の凝集、破壊により有効に抗原提示細胞に提示され、これにより自己反応性B細胞の親和性成熟がおこるという過程が、血小板減少、さらには血栓症の成因になるものと考えられる。 2GPIを含むであろう血小板抗原が、t-PA多型に由来する血小板の凝集、破壊により有効に抗原提示細胞に提示され、これにより自己反応性B細胞の親和性成熟がおこるという過程が、血小板減少、さらには血栓症の成因になるものと考えられる。 SLEは、いくつかの独立した疾患感受性遺伝子の相加的、相乗的作用で発症するに多遺伝子疾患である。SLEにおける個々の患者の症状の違いは、疾患感受性遺伝子の様々な組み合わせによって説明される。今回のt-PAの多型は、少なくとも一亜系のSLE合併APSにおいて一つの感受性遺伝子となっている可能性が示唆される。現在、ヒトAPSでの解析を行っている。これらの研究により、将来APSの発症機構が解明されるばかりでなく、さらに予防や治療におよぶ研究の発展がもたらされることが期待される。 |