学位論文要旨
| No | 115427 | |
| 著者(漢字) | 松原,康朗 | |
| 著者(英字) | ||
| 著者(カナ) | マツバラ,ヤスオ | |
| 標題(和) | ラット消化管形態形成における肝細胞増殖因子(Hepatocyte Growth Factor)の関与およびその調節機構 | |
| 標題(洋) | ||
| 報告番号 | 115427 | |
| 報告番号 | 甲15427 | |
| 学位授与日 | 2000.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第1613号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 内科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 消化管上皮組織は不断の増殖分化の営みを続ける高度に統制された組織であり,他臓器の実質細胞と同様に生体内因子および外的な環境因子間の複雑な相互作用によってその構造が形成・維持されている。こうした高次構造形成のメカニズムは十分に解明されているとは言いがたいが,古くから上皮間質相互作用と呼ばれる上皮系と間葉系の両組織間の相互作用が,上皮組織の機能を調節し,臓器の三次構造の確立・維持に大きな役割を果たしていることが指摘されている。教室における検討で,ラット胎児胃粘膜上皮を培養したところ,上皮組織のみの培養では形態変化が全く見られず,また腺胃分化のマーカーであるペプシノゲンの発現も認められなかった。一方,同じ胎児の間質を下に敷いて上皮組織の培養を行ったところ,腺管形成,ペプシノゲンの発現が認められた。これは消化管においても上皮組織の発生・分化に間質のサポートが極めて重要であることを示すものである。さらに上皮と間質の間にコラーゲンゲルを挟んで培養を行っても同様結果が得られており,その作用が主として液性因子を介したものであることが示唆された。 そこで本研究では,まず最初に間質由来で上皮に作用する上皮間質相互作用の仲介因子,特に液性細胞増殖因子の検索を行った。教室では新たにラット消化管の各部域を各発育段階で上皮と間質にコンタミネーションなく分離する手法を開発しており(Ichinose,M.et al.投稿中),これを利用して消化管各部域の上皮間質における代表的な増殖因子及びその受容体の遺伝子発現を検討した。 HGF(hepatocyte growth factor;肝細胞増殖因子)は代表的な間質由来増殖因子で,培養肝細胞の増殖を促進する因子として発見された。当初肝再生の本体として肝細胞特異的な増殖因子と考えられていたが,その後の検討で数多くの臓器に対し細胞増殖・遊走・形態形成など様々な活性を有するユニークな増殖因子であることが明らかになっている。 HGFは728アミノ酸残基の前駆体として合成され,細胞内で切断を受け一本鎖の不活型(proHGF)となる。さらに細胞外にてセリンプロテアーゼにより切断され,ヘテロ二量体の成熟型となる。HGFの産生は種々の因子により遺伝子翻訳のレベルで調節されているが,HGFが作用するためには二量体化が必須のため,proHGFの活性化もHGFの活性制御に重要な役割を果たしているものと考えられている。HGFの活性化に働く代表的な活性化因子がHGF activator(HGFA)である。HGFAはHGFの活性化を通して発生や傷害修復に寄与することが想定され,肝障害,腎障害,さらに胃潰瘍修復への関与が報告されているが,一方器官発生における役割は明らかではない。本研究ではラット消化管発生過程でのHGFの役割およびその活性制御のメカニズムを明らかにするためHGF,HGF受容体であるc-met,HGFA,さらにHGFAのインヒビターであるHGF activator inhibitor type1(HAI-1)を含め遺伝子発現の解析を行った。 [対象と方法]Fischer系ラット胎生15日から21日の胎児より消化管各部域(前胃,腺胃,十二指腸,大腸)を摘出。新たに開発したキレートと実体顕微鏡を用いた手法(Ichinose,M.et al.投稿中)で上皮・間質を分離した。各組織よりRNAを抽出しreverse transcription-polymerase chain reaction (RT-PCR)を用いmRNAの解析を行った。total RNA 5 [結果]胎生16日のラット消化管各部域における各種増殖因子(HGF,KGF,EGF,TGF HGF関連遺伝子について,同様に上皮,間質における分布を解析したところ,HGF mRNAは間質に限局して認められたがHGFA及びHAI-1 mRNAの発現は上皮のみに見られた。またc-met mRNAは上皮・間質とも発現が認められた。HGF,c-met mRNAの発現量は消化管各部域で大きな違いは認められなかったが,HGFA mRNAレベルは前胃で特に少なく,大腸で多いという頭尾軸にそった発現量の傾向が認められた。 ラット消化管は胎生後期の16日から21日で著明な構造変化が起きるが,腺胃間質におけるHGF mRNAの発現量は胎生16日では比較的少なく,これより徐々に増加し19日にピークが認められ,その後は出生前まで減少していた。腺胃上皮におけるc-metおよびHGFA mRNAの発現は類似したパターンを呈した。前半ではこれらも発現量が比較的少なく,胎性18日で小さなピークを形成した後19日でやや減少,その後増加して出生前で最大の発現量となっていた。HGF関連遺伝子の発現増加は消化管の他の部域においても認められた。HGF mRNAの発現は胎生16日より増加し,前胃では18日,十二指腸では17日,大腸では19日でピークを形成し,その後出生前まで減少していた。c-met mRNAの発現も組織分化,形態形成過程で発現増加がみられた。HGFA mRNAの発現は,前胃では発現量が少なく定量不能であったが,十二指腸,大腸ではこれも発現増加か認められた。 BrdU標識による上皮細胞増殖の検討では,腺胃における標識率は胎生18日でわずかに増加がみられるものの,全体としては胎生16日より出生前にかけ徐々に減少の傾向がみられた。前胃,十二指腸,大腸では標識率は胎生16日から21日まで漸減していた。 [考察]本研究ではまず消化管における上皮間質相互作用の仲介者,特に液性増殖因子をスクリーニングする目的で消化管各部域の上皮・間質における各種増殖因子及びその受容体の遺伝子発現の検討を行った。その結果,間質にのみ遺伝子発現が認められたのはHGF,KCFで,上皮にはその受容体c-met,KGF receptorの発現が認められた。これらの結果はHGF,KGFが消化管各部域において間質で産生され,受容体を発現している上皮組織に作用していることを示唆するものである。本研究では,その多彩な生理活性よりHGFに注目し検討を進めた。 HGF関連遺伝子の消化管各部域の上皮間質における発現パターンより消化管局所において間質より非活性型HGFが分泌され,標的組織の上皮レベルでHGFAにより活性化され作用する,さらにそのHGFAも上皮より分泌されるインヒビターにより制御される,というシステムが存在することが示唆された。消化管各部域の形態形成過程でHGF,c-met mRNA,の発現増加がみられたが,BrdU標識による解析では対応するような上皮細胞増殖は認められず,HGFが細胞増殖促進作用とは異なった作用,すなわち形態形成に働いていることが示唆された。HGFA mRNAも発生過程で発現増加を示しており(前胃では発現が少なく定量不能であったが),HGFの作用が局所における発現増加のみならず,HGFAによる活性化によっても調節されている可能性が示唆された。以上よりHGF関連遺伝子が空間的・時間的に厳密なコントロール下にあり,局所におけるHGFシステムがHGFAのHGF変換酵素としての働きとともに消化管形態形成に深く関与していることが強く示唆された。 | |
| 審査要旨 | 本研究は消化管発生に働く因子を明らかにするため,上皮間質相互作用に着目し,その代表的な仲介因子である液性細胞増殖因子の遺伝子発現の解析を試みたものである。ラット消化管各部域を各発育段階で上皮と間質にコンタミネーションなく分離する手法を利用し,消化管各部域の上皮間質における増殖因子及びその受容体の遺伝子発現をcompetitive reverse transcription-polymerase chain reaction(RT-PCR)を用い検討し以下の結果を得ている。 1.胎生16日のラット消化管各部域の上皮・間質における各種増殖因子及びその受容体(HGF,c-met,KGF,KGFR,EGF,TGF 本研究では,その多彩な生理活性よりHGFに注目し,HGF受容体であるc-met活性化因子であるHGF activator(HGFA),さらにHGFAのインヒビターであるHGF activator inhibitor type1(HAI-1)を含め検討を行い,さらに下記の結果を得ている。 2.HGF関連遺伝子の消化管各部域の上皮間質における発現パターンをRT-PCRにて検討したところ,HGF mRNAは間質に限局して認められたがHGFA及びHAI-1 mRNAの発現は上皮のみに見られた。またc-met mRNAは上皮・間質とも発現か認められた。この結果より消化管局所において間質より非活性型HGFが分泌され,標的組織の上皮レベルでHGFAにより活性化され作用する,さらにそのHGFAも上皮より分泌されるインヒビターにより制御される,というシステムが存在することが示唆された。 3.胎生16日から21日のラット消化管において,HGF関連遺伝子の経時的な発現変化をcompetitive RT-PCRを用いて検討したところ,消化管各部域の形態形成過程でHGF,c-met mRNA,の発現増加がみられた。BrdU標識による上皮細胞増殖の解析ではHGF遺伝子発現の増加と対応するような上皮細胞増殖パターンは認められず,組織像との対応からもHGFが細胞増殖促進作用とは異なった作用,すなわち形態形成に働いていることが示唆された。 4.さらにHGFA mRNAも消化管発生過程で発現増加を示しており,HGFの作用が局所における発現増加のみならず,HGFAによる活性化によっても調節されている可能性が示唆された。 以上,本論文はラット胎児消化管における増殖因子遺伝子発現の解析からHGF,KGFが間質由来増殖因子として働いていること,またHGFの消化管形態形成への関与,その制御機構を明らかにした。本研究は消化管における上皮間質相互作用,またHGFA,HAIを含めたHGFシステムの解明に重要な貢献をなすと考えられ,学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54123 |
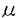 gよりcDNAを作成。特異的プライマーを用い35-40サイクルでPCRを施行した。mRNAの半定量にはcompetitive PCRを用いた。同じプライマーで増えるサイズの小さいcompetitorを作製。cDNAとともにcompetitorを加えPCRを施行すると,それぞれが濃度依存的に増幅され,アガロースゲル電気泳動で解析を行うとcompetitorよりのPCR産物は元のcDNAよりサイズが小さく分離される。定量にはイメージアナライザーを用い泳動ゲルを解析した。また上皮細胞増殖の評価のため消化管各部域組織を切出した後,細片に分割。フィルターに載せ,Dulbecco’s modified Eagle’s medium(DMEM)中に5-bromo-2’-deoxyuridine(BrdU;0.1mg/ml)を加え5%CO2,37℃で1時間培養を行った。標本はアセトン固定後,パラフィン包埋し,BrdUを取り込んだ核を特異的抗体を用い免疫組織染色で検出した。
gよりcDNAを作成。特異的プライマーを用い35-40サイクルでPCRを施行した。mRNAの半定量にはcompetitive PCRを用いた。同じプライマーで増えるサイズの小さいcompetitorを作製。cDNAとともにcompetitorを加えPCRを施行すると,それぞれが濃度依存的に増幅され,アガロースゲル電気泳動で解析を行うとcompetitorよりのPCR産物は元のcDNAよりサイズが小さく分離される。定量にはイメージアナライザーを用い泳動ゲルを解析した。また上皮細胞増殖の評価のため消化管各部域組織を切出した後,細片に分割。フィルターに載せ,Dulbecco’s modified Eagle’s medium(DMEM)中に5-bromo-2’-deoxyuridine(BrdU;0.1mg/ml)を加え5%CO2,37℃で1時間培養を行った。標本はアセトン固定後,パラフィン包埋し,BrdUを取り込んだ核を特異的抗体を用い免疫組織染色で検出した。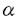 ,HB-EGF,Amphiregulin,TGF
,HB-EGF,Amphiregulin,TGF 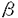 1,BMP-2,BMP-4,Activin)の遺伝子発現は以下の通りであった。1)間質にのみ遺伝子発現が認められるのはHGF,KGFであった。2)その受容体c-met,KGFreceptor mRNAの発現は上皮,間質ともに認められた。3)EGF,HB-EGFは上皮,間質ともに遺伝子発現が認められた。4)TGF
1,BMP-2,BMP-4,Activin)の遺伝子発現は以下の通りであった。1)間質にのみ遺伝子発現が認められるのはHGF,KGFであった。2)その受容体c-met,KGFreceptor mRNAの発現は上皮,間質ともに認められた。3)EGF,HB-EGFは上皮,間質ともに遺伝子発現が認められた。4)TGF