| 内容要旨 | | 炎症細胞がになう遊走、貪食、顆粒分泌などの起炎機能は、種々の細胞表面受容体を介する独自の信号伝達経路によって制御されている。今回私は炎症細胞の細胞表面受容体と起炎機能を結ぶトランスデューサーとして、非レセプター型チロシンキナーゼ、Srcファミリーチロシンキナーゼに注目した。Srcファミリーは9種類からなり、各種の細胞には複数のSrcファミリーキナーゼが発現している(1)。これらの複数のメンバーが互いに機能的に代償しあう場合があることが分かってきた。 C-terminal Src kinase(Csk)はSrcファミリーキナーゼの調節部位の一つであるC末端のチロシンをリン酸化する(2)。リン酸化されたチロシンを含むC末端の配列は、Srcファミリーキナーゼ自身のSH2ドメインと分子内結合を起こす。これによる立体構造の変化の結果、Srcキナーゼ活性が抑制される。我々は、このようなCskによるSrcファミリーキナーゼの活性抑制機構が、全てのSrcファミリーキナーゼ分子に共通であることに着目し、Cskの野生型及びその改変体を利用して、Srcファミリーキナーゼ活性全体を制御する手法を導入した。我々はすでにこれらの分子をマスト細胞系細胞株RBL2H3に高発現させて、高親和性IgE受容体(Fc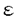 RI)を介するシグナルを解析し、c-SrcのN末端シークエンスを付加した(3)膜結合型Csk(mCsk)が、野生型Csk以上の強力な抑制効果を持つ事を確認した(4)。今回私はC末端の調節領域のチロシンを除去したSrcファミリーキナーゼ改変体(3)を用いて、mCskによって抑制された機能が回復するか否かを指標に、Srcファミリー分子の特異性を解析した。 RI)を介するシグナルを解析し、c-SrcのN末端シークエンスを付加した(3)膜結合型Csk(mCsk)が、野生型Csk以上の強力な抑制効果を持つ事を確認した(4)。今回私はC末端の調節領域のチロシンを除去したSrcファミリーキナーゼ改変体(3)を用いて、mCskによって抑制された機能が回復するか否かを指標に、Srcファミリー分子の特異性を解析した。 私はまず、インテグリンを介する接着・遊走におけるSrcファミリーキナーゼの関与について、マスト細胞系細胞株RBL2H3を用いて検討した。RBL2H3細胞の親株は活性型のc-kitを発現しているため(5)、フイブロネクチン(fibronectin,Fn)コート表面にプライミング処理なしでも接着し、白血球に特徴的な接着構造であるpodosomeを形成した。また、FnはRBL2H3細胞を遊走させた。この様にRBL2H3細胞は、Fn刺激によって惹起されるインテグリンのoutside-in signalingを解析する実験系として有用と考えられた。CskあるいはmCskの高発現はFnコート表面への細胞接着及び接着部位への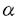 5インテグリンの動員は障害しなかったが、paxillinをはじめとする細胞内蛋白質のチロシンリン酸化、F-アクチン集合によるpodosome形成、及びFnに対する遊走は、Cskによって抑制され、mCskによっては更に強く抑制されほぼ消失した。これらの抑制効果はキナーゼ活性依存性であった。 5インテグリンの動員は障害しなかったが、paxillinをはじめとする細胞内蛋白質のチロシンリン酸化、F-アクチン集合によるpodosome形成、及びFnに対する遊走は、Cskによって抑制され、mCskによっては更に強く抑制されほぼ消失した。これらの抑制効果はキナーゼ活性依存性であった。 mCsk発現細胞にC末端調節性チロシンを除去したLyn(a-Lyn)を共発現させると、podosome形成及びFnに対する遊走が回復した。一方、C末端調節性チロシンを除去したc-Src(a-Src)の共発現は、podosome形成を回復させたが、Fnに対する遊走は回復させなかった。以上の結果から、Fnによって惹起される細胞骨格再構成とそれに基づく遊走にSrcファミリーキナーゼが必要であること、更にLynがこのFnによるpodosome形成と遊走に至るシグナルを媒介し得ることが示唆された。またインテグリンを介する細胞運動においてLynとc-Srcは異なった様式で関与することが示唆された。 私は次に、Fc 受容体を介する貪食におけるSrcファミリーキナーゼの関与について、マクロファージ細胞系細胞株RAW264.7を用いて検討した。RAW264.7細胞の親株はIgGコートビーズ及び抗Fc 受容体を介する貪食におけるSrcファミリーキナーゼの関与について、マクロファージ細胞系細胞株RAW264.7を用いて検討した。RAW264.7細胞の親株はIgGコートビーズ及び抗Fc RII/III単クローン抗体(2.4G2)コートビーズをよく貪食した。また抗Fc RII/III単クローン抗体(2.4G2)コートビーズをよく貪食した。また抗Fc RII/III抗体にてコートした表面上に接着させると、接着面に特徴的なリング状のF-アクチン構造を形成した。IgGコートビーズの貪食、固相化抗Fc RII/III抗体にてコートした表面上に接着させると、接着面に特徴的なリング状のF-アクチン構造を形成した。IgGコートビーズの貪食、固相化抗Fc RII/III抗体によるF-アクチン再構成、及びFc RII/III抗体によるF-アクチン再構成、及びFc RII/III架橋刺激によるSykの活性化は、Cskによって抑制され、mCskによっては更に強く抑制された。しかしこれらの分子は、細胞表面のFc RII/III架橋刺激によるSykの活性化は、Cskによって抑制され、mCskによっては更に強く抑制された。しかしこれらの分子は、細胞表面のFc RII/III発現量、及びIgGコートSRBCのロゼット形成能に大きな影響を与えなかった。これらの抑制効果はキナーゼ活性依存性であった。 RII/III発現量、及びIgGコートSRBCのロゼット形成能に大きな影響を与えなかった。これらの抑制効果はキナーゼ活性依存性であった。 mCsk発現細胞にC末端除去Lyn(a-Lyn)あるいはC末端除去Hck(a-Hck)を共発現させると、固相化抗Fc RII/III抗体によるF-アクチン再構成とFc RII/III抗体によるF-アクチン再構成とFc 受容体を介する貪食が回復し、Fc 受容体を介する貪食が回復し、Fc RII/III架橋刺激によるSykの活性化も回復した。一方、C末端除去c-Src(a-Src)の共発現は、貪食、F-アクチン再構成をともに回復させなかった。a-Srcの共発現によってFc RII/III架橋刺激によるSykの活性化も回復した。一方、C末端除去c-Src(a-Src)の共発現は、貪食、F-アクチン再構成をともに回復させなかった。a-Srcの共発現によってFc RII/III架橋刺激によるSykのチロシンリン酸化は部分的に見られたが、Sykの活性化の回復は起こらなかった。付け加えて、Fc RII/III架橋刺激によるSykのチロシンリン酸化は部分的に見られたが、Sykの活性化の回復は起こらなかった。付け加えて、Fc RII/III架橋刺激によるFc RII/III架橋刺激によるFc RIIBのチロシンリン酸化も、a-Lynあるいはa-Hckによって回復するものの、a-Srcによっては回復しなかった。ショ糖勾配遠心分画法で評価したところ、a-Lyn、a-Hck、a-Srcはいずれも異なる細胞内局在を呈し、detergent resistant membrane microdomains(DRMs)(6)と考えられる画分への局在はa-Srcが最も少ながった。以上の結果から、Fc RIIBのチロシンリン酸化も、a-Lynあるいはa-Hckによって回復するものの、a-Srcによっては回復しなかった。ショ糖勾配遠心分画法で評価したところ、a-Lyn、a-Hck、a-Srcはいずれも異なる細胞内局在を呈し、detergent resistant membrane microdomains(DRMs)(6)と考えられる画分への局在はa-Srcが最も少ながった。以上の結果から、Fc 受容体を介する貪食にSrcファミリーキナーゼが必要であることが強く示唆された。またLyn及びHckがFc 受容体を介する貪食にSrcファミリーキナーゼが必要であることが強く示唆された。またLyn及びHckがFc 受容体を介するSykの活性化とphagosome形成を含む貪食のための陽性シグナルを媒介し得ること、c-Srcはこれができないことが示唆された。加えて、陰性シグナルの端緒となるFc 受容体を介するSykの活性化とphagosome形成を含む貪食のための陽性シグナルを媒介し得ること、c-Srcはこれができないことが示唆された。加えて、陰性シグナルの端緒となるFc RIIBのチロシンリン酸化がLyn及びHckによって行われ、c-Srcによっては行われないことが示唆された。 RIIBのチロシンリン酸化がLyn及びHckによって行われ、c-Srcによっては行われないことが示唆された。 マスト細胞株におけるインテグリンを介する遊走と、マクロファージ細胞株におけるFc 受容体を介する貪食それぞれについて、Srcファミリーキナーゼの選択的なメンバーが必要であることを今回提示した。各Srcファミリー分子のDRMへの局在が異なることが、各分子の機能の違いの原因かもしれない。私が使用したSrcファミリーキナーゼの変異体が、野生型のSrcファミリーキナーゼのようなC末端チロシンリン酸化と脱リン酸化の平衡にないことは当然考慮に入れなければならない。しかし重複して機能するSrcファミリーキナーゼを解析する上で、mCsk発現細胞を機能的なSrcファミリーキナーゼを欠くバックグラウンドとして用いることは、Srcファミリーキナーゼノックアウト動物からの知見を補足するのに有用な手法と思われる。 受容体を介する貪食それぞれについて、Srcファミリーキナーゼの選択的なメンバーが必要であることを今回提示した。各Srcファミリー分子のDRMへの局在が異なることが、各分子の機能の違いの原因かもしれない。私が使用したSrcファミリーキナーゼの変異体が、野生型のSrcファミリーキナーゼのようなC末端チロシンリン酸化と脱リン酸化の平衡にないことは当然考慮に入れなければならない。しかし重複して機能するSrcファミリーキナーゼを解析する上で、mCsk発現細胞を機能的なSrcファミリーキナーゼを欠くバックグラウンドとして用いることは、Srcファミリーキナーゼノックアウト動物からの知見を補足するのに有用な手法と思われる。 参考文献1.Brown,M.T.,and J.A.Cooper.1996.Regulation,substrates and functions of src.Biochim.Biophys.Acta 1287:121-49.2.Nada,S.,M.Okada,A.MacAuley,J.A.Cooper,and H.Nakagawa.1991.Cloning of a complementary DNA for a protein-tyrosine kinase that specifically phosphorylates a negative regulatory site of p60c-src.Nature 351:69-72.3.Chow,L.M.,M.Fournel,D.Davidson,and A.Veillette.1993.Negative regulation of T-cell receptor signalling by tyrosine protein kinase p50csk.Nature 365:156-60.4.Honda,Z.,T.Suzuki,N.Hirose,M.Aihara,T.Shimizu,S.Nada,M.Okada,C.Ra,Y.Morita,and K.Ito.1997.Roles of C-terminal Src kinase in the initiation and the termination of the high affinity IgE receptor-mediated signaling.J.Biol.Chem.272:25753-60.5.Tsujimura,T.,T.Furitsu,M.Morimoto,Y.Kanayama,S.Nomura,Y.Matsuzawa,Y.Kitamura,and Y.Kanakura.1995.Substitution of an aspartic acid results in constitutive activation of c-kit receptor tyrosine kinase in a rat tumor mast cell line RBL-2H3.Int.Arch.Allergy Immunol.106:377-85.6.Simons,K.,and E.Ikonen.1997.Functional rafts in cell membranes.Nature 387:569-72. |
| 審査要旨 | | 本研究は重要な細胞内シグナル伝達分子であるSrcファミリーチロシンキナーゼの働きについて、骨髄球系炎症細胞における細胞の遊走及び貪食という代表的な起炎機能に関して検討したものである。Srcファミリーチロシンキナーゼは各種細胞において、ファミリーに含まれる複数のキナーゼが重複して発現しており、お互いに機能的に代償する場合があることが知られている。このためSrcファミリーキナーゼが特定の細胞機能に必要であるかどうかを検討するのは容易ではない。この点について、本研究ではSrcファミリーキナーゼの抑制分子であるC-terminal Src kinase(Csk)を機能増強型とした変異体(mCsk)を利用し、これをマスト細胞株及びマクロファージ細胞株に高発現させることによって検討することを試みている。また、特定の細胞機能においてSrcファミリーキナーゼのうちの個々のメンバーがいかに関与しているかを解析するために異なる種類のSrcファミリーキナーゼのC末端の調節領域のチロシンを除去した変異体を作成し、mCskによって内因性のSrcファミリーキナーゼ全体の活性を強く抑制した細胞株に共発現させ、mCskによって抑制された機能が回復するか否かを検討した。この結果、下記の様な知見を得ている。 1.マスト細胞系細胞株RBL2H3を用いてフィブロネクチン(Fn)刺激によって惹起されるインテグリンのoutside-in signalingを解析したところ、CskあるいはmCskの高発現はFnコート表面への細胞接着及び接着部位への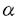 5インテグリンの動員は障害しなかったが、paxillinをはじめとする細胞内蛋白質のチロシンリン酸化、F-アクチン集合によるpodosome形成、及びFnに対する遊走は、Cskによって抑制され、mCskによっては更に強く抑制されほぼ消失した。これらの抑制効果はキナーゼ活性依存性であった。mCsk発現細胞にC末端調節性チロシンを除去したLyn(a-Lyn)を共発現させると、podosome形成及びFnに対する遊走が回復した。一方、C末端調節性チロシンを除去したc-Src(a-Src)の共発現は、podosome形成を回復させたが、Fnに対する遊走は回復させなかった。以上の結果から、Fnによって惹起される細胞骨格再構成とそれに基づく遊走にSrcファミリーキナーゼが必要であること、更にLynがこのFnによるpodosome形成と遊走に至るシグナルを媒介し得ることが示唆された。またインテグリンを介する細胞運動においてLynとc-Srcは異なった様式で関与することが示唆された。 5インテグリンの動員は障害しなかったが、paxillinをはじめとする細胞内蛋白質のチロシンリン酸化、F-アクチン集合によるpodosome形成、及びFnに対する遊走は、Cskによって抑制され、mCskによっては更に強く抑制されほぼ消失した。これらの抑制効果はキナーゼ活性依存性であった。mCsk発現細胞にC末端調節性チロシンを除去したLyn(a-Lyn)を共発現させると、podosome形成及びFnに対する遊走が回復した。一方、C末端調節性チロシンを除去したc-Src(a-Src)の共発現は、podosome形成を回復させたが、Fnに対する遊走は回復させなかった。以上の結果から、Fnによって惹起される細胞骨格再構成とそれに基づく遊走にSrcファミリーキナーゼが必要であること、更にLynがこのFnによるpodosome形成と遊走に至るシグナルを媒介し得ることが示唆された。またインテグリンを介する細胞運動においてLynとc-Srcは異なった様式で関与することが示唆された。 2.マクロファージ細胞系細胞株RAW264.7を用いてFc 受容体を介する機能について検討したところ、Fc 受容体を介する機能について検討したところ、Fc 受容体を介するIgGコートビーズの貪食、固相化抗Fc 受容体を介するIgGコートビーズの貪食、固相化抗Fc RII/III抗体によるF-アクチン再構成、及びFc RII/III抗体によるF-アクチン再構成、及びFc RII/III架橋刺激によるSykの活性化は、Cskによって抑制され、mCskによっては更に強く抑制された。これらの抑制効果はキナーゼ活性依存性であった。mCsk発現細胞にa-Lynあるいはa-Hck(C末端除去Hck)を共発現させると、Fc RII/III架橋刺激によるSykの活性化は、Cskによって抑制され、mCskによっては更に強く抑制された。これらの抑制効果はキナーゼ活性依存性であった。mCsk発現細胞にa-Lynあるいはa-Hck(C末端除去Hck)を共発現させると、Fc 受容体を介する貪食、F-アクチン再構成及びSykの活性化が回復した。一方、a-Srcの共発現はいずれをも回復させなかった。加えて、Fc 受容体を介する貪食、F-アクチン再構成及びSykの活性化が回復した。一方、a-Srcの共発現はいずれをも回復させなかった。加えて、Fc RII/III架橋刺激によるFc RII/III架橋刺激によるFc RIIBのチロシンリン酸化も、a-Lynあるいはa-Hckによって回復するが、a-Srcによっては回復しなかった。以上の結果から、Fc RIIBのチロシンリン酸化も、a-Lynあるいはa-Hckによって回復するが、a-Srcによっては回復しなかった。以上の結果から、Fc 受容体を介する貪食にSrcファミリーキナーゼが必要であることが強く示唆された。またLyn及びHckがFc 受容体を介する貪食にSrcファミリーキナーゼが必要であることが強く示唆された。またLyn及びHckがFc 受容体を介するSykの活性化とphagosome形成を含む貪食のための陽性シグナルを媒介し得ること、c-Srcはこれができないことが示唆された。加えて、陰性シグナルの端緒となるFc 受容体を介するSykの活性化とphagosome形成を含む貪食のための陽性シグナルを媒介し得ること、c-Srcはこれができないことが示唆された。加えて、陰性シグナルの端緒となるFc RIIBのチロシンリン酸化がLyn及びHckによって行われ、c-Srcによっては行われないことが示唆された。 RIIBのチロシンリン酸化がLyn及びHckによって行われ、c-Srcによっては行われないことが示唆された。 以上、本論文は骨髄球系の炎症細胞において重要な起炎機構である遊走・貪食におけるSrcファミリーキナーゼの必要性と特異性を明らかにした。本研究はその機能的重複性ゆえこれまでのノックアウト動物を用いた手法では容易ではなかったSrcファミリーキナーゼの必要性・特異性の検討を、新たな手法を導入して解析した点で独創的であり、受容体直近の非受容体型チロシンキナーゼの機能の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |