| 内容要旨 | | 緒言 血管内皮細胞は血管内面を一層に覆う細胞であるが、単に血管内腔と内皮下組織の間の障壁として存在するのみならず、血液中の様々な刺激(ホルモン、サイトカインなど液性因子、脂質、酸化ストレス、血球の接着など)を受容し、血管のトーヌス、抗血栓作用、血管新生、物質透過性の調節など血管の恒常性維持に中心的な役割を果たしている。また内皮細胞は血流によってもたらされるずり応力(shear stress)、伸展張力(cyclic stretch)や圧力(compressive stress)などの血行力学的応力に常にさらされている。近年こうした血行力学的応力に対し血管内皮細胞が反応し形態や機能を変化させ、多くの場合その機能に関連した遺伝子発現も同時に変化させていることが明らかになってきた。 従来、血管新生やリモデリングに血行力学的応力が深く関わっていることが指摘されてきた。また粥状動脈硬化症は動脈の彎曲部や分岐部に好発することがよく知られているが、このような部位では血流の剥離や乱流形成がおこり、ずり応力は低くなっており、血管内皮細胞機能を障害している可能性があると考えられている。小児循環器領域では先天性心疾患に合併する二次性肺高血圧症発症機序に一酸化窒素(nitric oxide:NO)やエンドセリン(endothelin1:ET)などの血管作動性物質の不均衡が指摘されており、血行動態変化に基づく血管内皮機能異常がその成因として有力視されている。 これまで血管内皮細胞に対し血行力学的応力の作用を見るin vitroの実験系には様々な応力負荷装置が用いられてきた。しかしいずれも単独の応力負荷装置であり、ずり応力、伸展張力、圧力が同時にかかるin vivoの物理環境を再現することは困難であった。したがって本研究では血管を模したシリコン製の弾性円筒管内腔に血管内皮細胞を培養し、ずり応力、伸展張力、圧力を独立ないし同時に作用させる事ができる装置を開発し、代表的な血管作動性物質であるNO合成酵素(nitric oxide synthase:NOS)、ETのmRNA発現と転写調節に及ぼす血行力学的応力の作用を検討した。 研究方法と結果1.ずり応力、伸展張力、圧力負荷装置の開発 1)装置は半閉鎖回路となっており、ポンプ、ディパルセーター、チャンバー、バルブ、リザーバーの5つの構成要素からなる。ポンプはDCサーボモーター駆動の遠心ポンプで、回転数を変えることにより、流量、内圧を制御できる。ディパルセーターは圧波形の高周波成分を除き平滑化する。チャンバーは3本のチューブホルダーを装着でき、バルブで出力抵抗を調節し回路内圧を制御する。回路内流量は超音波流量計(HT107,Transonic System Inc.,NY,USA)で内圧は圧力トランスデューサー(DX300,NIHON KOHDEN,Tokyo)で、シリコンチューブの外径はレーザー寸法測定器(LS5500,KEYENCE,Tokyo)でそれぞれ測定した。これらすべてのデータはA/D変換カード(NR250,KEYENCE)を介してコンピューターに記録した。 2)血管の機械特性に近く、薄く均質なシリコンチューブを形成するためにディッピング装置を作製した。径4mmの鋳型棒をシリコンエラストマーに浸し、一定速度で引き上げ、厚さ約90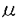 mの均質なシリコンチューブを作成した。このチューブは100mmHgの内圧に対し約10%の伸展度で、生体の大動脈に近い特性となった。この回路によりずり応力15dyn/cm2、伸展張力10%、平均内圧80mmHgで生理的な動脈波形に近い拍動流を再現することができた。実際の流れはポリスチレンパーティクルを溶液に懸濁しハイスピードビデオカメラ(NAC,HSV500,Tokyo)で可視化し、乱流でないことを確認した。24時間の応力負荷実験後も細胞傷害を認めず、長時間の応力負荷が可能であった。 mの均質なシリコンチューブを作成した。このチューブは100mmHgの内圧に対し約10%の伸展度で、生体の大動脈に近い特性となった。この回路によりずり応力15dyn/cm2、伸展張力10%、平均内圧80mmHgで生理的な動脈波形に近い拍動流を再現することができた。実際の流れはポリスチレンパーティクルを溶液に懸濁しハイスピードビデオカメラ(NAC,HSV500,Tokyo)で可視化し、乱流でないことを確認した。24時間の応力負荷実験後も細胞傷害を認めず、長時間の応力負荷が可能であった。 2.ずり応力、伸展張力、圧力に対する遺伝子発現応答の解析1)力学的応力単独負荷と同時負荷の比較 ヒト臍帯静脈由来内皮細胞(HUVEC)を弾性円筒管内に培養し、灌流装置に装着した。ずり応力:0.3,7,15[dyn/cm2]、伸展張力:0,10[%]、平均内圧:0,80[mmHg]の3条件を組み合わせ負荷実験を行った。24時間負荷終了後Total RNAを抽出しRT-PCR法によりNOS,ETのmRNAレベルの変化を検討した。 (1)NOSのmRNAレベルはずり応力単独負荷により静的コントロールの2.2倍(7[dyn/cm2]),3.2倍(15[dyn/cm2])に増加したが、伸展張力、圧力単独負荷では1.1倍で有意な変化を認めなかった。ずり応力、圧力、伸展張力の同時負荷では2.2倍(7[dyn/cm2])、2.8倍(15[dyn/cm2])でずり応力単独負荷と有意な差を認めなかった。 (2)ETのmRNAはずり応力により静的コントロールの0.89倍(7[dyn/cm2]),0.56倍(15[dyn/cm2])に低下した。逆に圧力(80mmHg)、伸展張力(10%)では約1.7倍に増加した。ずり応力、伸展張力、圧力を同時負荷すると各々の効果が抑制されcontrolの87%となった。 2)定常流と拍動流の比較 ずり応力7dyn/cm2、平均内圧80mmHgの定常流で一定の伸展張力10%の場合と、拍動流で10%伸展張力を負荷した場合でのET,NOSのmRNAの変化を検討した。ETmRNAレベルは拍動流で0.92倍、定常流で0.97倍で両者に有意な差を認めなかった。NOSmRNAレベルは拍動流で2.2倍、定常流で2.0倍でET,NOSともに、拍動流と定常流で有意な差を認めなかった。 3)伸展張力と圧力の比較 ETのmRNA発現における圧力と伸展張力の効果を比較するために、弾性チューブの全周を伸展しないようにカプセルで覆い、伸展張力0%で圧力負荷を行えるようにした。負荷実験は伸展張力0%、10%、圧力40mmHg、80mmHgを組み合わせた条件で行った。圧力負荷に対し40mmHgではETのmRNAレベルに有意な差を認めなかったが、80mmHgで1.6倍に増加した。伸展張力負荷に対しては内圧40mmHg,80mmHgいずれの条件でも有意な差を認めず、圧力による作用が優位であることが明らかになった。 4)ET転写調節機序の検討 ずり応力、圧力に対するET遺伝子の転写応答に重要な役割を果たす応答配列を同定するためにプロモーターを含むET染色体遺伝子3.6kbをルシフェラーゼベクターに組込んだreporter geneを用いた転写アッセイを行った。 (1)ずり応力に対する応答配列の検討 シスエレメントの部位を推定するために転写開始点上流2.8kb,2.5kb,,2.1kb 1.9kb,1.0kbの領域を含むルシフェラーゼベクターを作成しdeletion analysisを行った。その結果3.6kb上流で見られたずり応力による転写抑制が2.8kbでは認められず、逆に転写活性が亢進た。さらに2.1kbまでdeletionを加えるとこの反応も消失した。このことから転写活性抑制のシスエレメントは-2.8k〜-3.6kbの領域に、また転写を正に調節する領域が-2.1kbから-2.5kbの領域に存在することが明らかになった。転写活性抑制のシスエレメントを同定するために転写開始点上流-2816〜-2819bpに存在するNF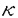 Bサイトにmutationをいれ、ずり応力に対する反応を検討した。ずり応力負荷後転写活性は1.5倍となりNF Bサイトにmutationをいれ、ずり応力に対する反応を検討した。ずり応力負荷後転写活性は1.5倍となりNF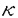 Bサイトがずり応力に対するサイレンサーとして機能していることが明らかになった。 Bサイトがずり応力に対するサイレンサーとして機能していることが明らかになった。 (2)圧力に対する応答配列の検討 圧力負荷による転写活性亢進の責任部位を明らかにするために転写開始点上流-2.8kb,-2.5kb,-1.9kb,-1.0kb,-0.6kb,-0.4kb,-0.3kb-0.2kbの領域を含むルシフェラーゼベクターを作成しdeletion analysisを行った。その結果-0.3kb上流までは圧力負荷に対する反応が保たれているが、-0.2kb上流までdeletionを加えるとこの反応が消失した。このことから圧力負荷に対するシスエレメントは-158bp〜-267bpの間に存在することが示された。 総括 細胞親和性の高いシリコンチューブと遠心ポンプを組み合わせ、ずり応力、伸展張力、圧力を単独及び同時負荷できる装置を開発することができた。この装置を用いた検討により、各応力の単独負荷と同時負荷でET,NOSの遺伝子発現応答が異ることが示された。さらにET遺伝子の転写調節に関わるずり応力応答配列と圧力応答配列が異る部位に存在することが判明した。 |
| 審査要旨 | | 本研究では血管を模した弾性円筒管内腔に血管内皮細胞を培養し、ずり応力、伸展張力、圧力を独立及び同時に作用させる装置を開発し、NOS、ETのmRNA発現と転写調節に及ぼす血行力学的応力の作用を検討し下記の結果を得た。 1.ずり応力、伸展張力、圧力負荷装置の開発 厚さ約90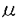 mの均質なシリコンチューブを作成し、生体の血管に近い物理特性を再現した。遠心ポンプを応用した灌流装置はずり応力15dyn/cm2、伸展張力10%、平均内圧80mmHgで生理的な動脈波形に近い拍動流を得られた。 mの均質なシリコンチューブを作成し、生体の血管に近い物理特性を再現した。遠心ポンプを応用した灌流装置はずり応力15dyn/cm2、伸展張力10%、平均内圧80mmHgで生理的な動脈波形に近い拍動流を得られた。 2.ずり応力、伸展張力、圧力に対する遺伝子発現応答の解析 ヒト臍帯静脈由来内皮細胞(HUVEC)を弾性円筒管内に培養し、灌流装置に装着した。ずり応力:0.3,7,15[dyn/cm2]、伸展張力:0,10[%]、平均内圧:0,80[mmHg]の3条件を組み合わせ負荷実験を行った。24時間負荷終了後Total RNAを抽出しRT-PCR法によりNOS,ETのmRNAレベルの変化を検討した。 (1)NOSのmRNAレベルはずり応力単独負荷により静的コントロールの約3倍(15[dyn/cm2])に増加したが、伸展張力、圧力単独負荷では有意な変化を認めなかった。ずり応力、圧力、伸展張力の同時負荷でも約3倍(15[dyn/cm2])でずり応力単独負荷と有意な差を認めなかった。 (2)ETのmRNAはずり応力により静的コントロールの0.56倍(15[dyn/cm2])に低下した。逆に圧力(80mmHg)、伸展張力(10%)では約1.7倍に増加した。ずつ応力、伸展張力、圧力を同時負荷すると各々の効果が抑制されcontrolの87%となった。また圧力と伸展張力の効果を比較するために、弾性チューブの全周を伸展しないようにカプセルで覆い、伸展張力0%で圧力負荷を行えるようにした。負荷実験は伸展張力0%、10%、圧力40mmHg、80mmHgを組み合わせた条件で行った。80mmHgの圧力負荷に対し1.6倍に増加した。伸展張力負荷に対しては有意な差を認めず、圧力による作用が優位であることが明らかになった。 3.ET転写調節機序の検討 ずり応力、圧力に対するET遺伝子の転写応答に重要な役割を果たす応答配列を同定するためにプロモーターを含むET染色体遺伝子3.6kbをルシフェラーゼベクターに組込んだreporter geneを用いた転写アッセイを行った。 (1)ずり応力に対する応答配列の検討 シスエレメントの部位を推定するためにdeletion analysisを行った。その結果3.6kb上流で見られたずり応力による転写抑制が2.8kbでは認められず、逆に転写活性が亢進した。さらに2.1kbまでdeletionを加えるとこの反応も消失した。このことから転写活性抑制のシスエレメントは-2.8k〜-3.6kbの領域に、また転写を正に調節する領域が-2.1kbから-2.5kbの領域に存在することが明らかになった。さらにmutation analysisにより、転写開始点上流-2816〜-2819bpに存在するNF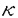 Bサイトがずり応力に対するサイレンサーとして機能していることが明らかになった。 Bサイトがずり応力に対するサイレンサーとして機能していることが明らかになった。 (2)圧力に対する応答配列の検討 deletion analysisを行った結果、-0.3kb上流までは圧力負荷に対する反応が保たれているが、-0.2kb上流までdeletionを加えるとこの反応が消失した。このことから圧力負荷に対するシスエレメントは-158bp〜-267bpの間に存在することが示された。 以上、ずり応力、伸展張力、圧力を単独及び同時負荷できる装置を新に開発し、この装置を用いた検討により、各応力の単独負荷と同時負荷でET、NOSの遺伝子発現応答が異ることが示された。さらにずり応力に対するET遺伝子発現のサイレンサーがNF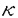 B配列であることを示し、さらにET遺伝子の転写調節に関わるずり応力応答配列と圧力応答配列が異る部位に存在することが明かとなった。本研究は血管内皮細胞が物理的応力の方向性を検知し、独立した情報伝達系路を持つ可能性を示した論文であり、学位の授与に値するものと考えられる。 B配列であることを示し、さらにET遺伝子の転写調節に関わるずり応力応答配列と圧力応答配列が異る部位に存在することが明かとなった。本研究は血管内皮細胞が物理的応力の方向性を検知し、独立した情報伝達系路を持つ可能性を示した論文であり、学位の授与に値するものと考えられる。 |