学位論文要旨
| No | 115445 | |
| 著者(漢字) | 木村,秀生 | |
| 著者(英字) | ||
| 著者(カナ) | キムラ,ヒデオ | |
| 標題(和) | 一酸化窒素による血管内皮増殖因子遺伝子転写活性化機構の解析 | |
| 標題(洋) | Molecular Mechanisms of Activation of Vascular Endothelial Growth Factor Gene by Nitric Oxide | |
| 報告番号 | 115445 | |
| 報告番号 | 甲15445 | |
| 学位授与日 | 2000.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第1631号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 外科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 血管内皮増殖因子(VEGF)は、生体における血管新生において中心的な役割を果たしている増殖因子の一つである。VEGF遺伝子を活性化する因子として、低酸素、サイトカインや増殖因子、癌遺伝子などが報告されている。VEGFは腫瘍細胞、マクロファージ、血管平滑筋細胞、血管内皮細胞(EC)などで産生され、放出されたVEGFはECの膜表面にある特異的な受容体に結合し、ECの増殖能と遊走能を活性化する。また、VEGFはVPF(vascular permeability factor)ともいわれ、血管壁の透過性を亢進する働きがあり、この2つの働きが胎児の血管新生や創傷治癒、虚血組織の側副血行路の発達、網膜炎や関節炎、腫瘍における血管新生に深く関与している。低酸素によるVEGFの転写活性化機構については広く研究されていて、現在最もよく知られている制御機構はVEGFのプロモーター領域にあるHRE(hypoxia response element)に低酸素で活性化された転写因子HIF-1(hypoxia-inducible factor 1)が結合することによってVEGF遺伝子の転写が活性化されるというものである。HIF-1はHIF-1 一酸化窒素(NO)はEDRF(endothelium-derived relaxing factor)として知られ、ECだけでなく神経細胞や上皮細胞、マクロファージなど多くの細胞でNO合成酵素(NOS)によりL-arginineから合成される。NOは生体内で平滑筋弛緩や神経伝達物質だけでなく、細胞内伝達物質としても働き、様々な生体反応に関与していることが明らかになってきた。この働きの多くはguanylate cyclase(GC)/cGMP経路を介していると考えられている。最近になってNOが血管新生やVEGF遺伝子の制御に関与しているという報告が相次いでされてきた。さらに、NOが転写レベルでVEGFの発現を活性化していることが明らかになったことから、この論文ではその活性化機構を明らかにするためにヒトglioblastomaとhepatoma細胞を用いて、そのcis-elementsとtrans-activating factorsの解析を詳細に行った。 ヒトVEGF遺伝子プロモーター領域の約2.3kbpsをluciferase発現ベクターに組み込んだphVEGF1とLacZ発現ベクターをlipofectinを用いて、ヒトglioblastoma A-172細胞またはhepatoma Hep3B細胞に導入した。NO発生試薬でこれらの細胞を処理した後に、抽出した蛋白のluciferase活性と VEGFプロモーターはSNAPと低酸素のいずれによっても活性化され、A-172細胞では刺激後12時間、Hep3B細胞では36時間で最大となった。SNAPの至適濃度は21%酸素において0.5mMであったが、1%酸素下では低酸素の影響と相加的に働き、0.125〜0.25mMで活性化は最大となった。さらにそれよりも高濃度になると低酸素による活性化は著明に抑制された。他のNO供与体NOC5でも同様の結果が得られた。以上のことからNOがVEGF遺伝子の転写を活性化し、その至適濃度は周囲の酸素濃度に依存することが分かった。GC阻害剤であるmethylene blueとLY83583はNOによる誘導だけを抑制したが、他のGC阻害剤ODQはNOによる誘導を抑制せず、また、8-Br-cGMP(protein kinase G activatorもVEGFプロモーターを活性化しなかった。この結果から、NOによるVEGF遺伝子の転写活性化はGC非依存性であることが示唆された。 phVEGF1のdeletion mutantsを作成し、そのNOと低酸素に対する誘導性を調べたところ、転写開始部位を起点に-1014から-794の範囲の欠損でNOと低酸素に対する誘導は完全に消失した。この範囲をthymidine kinase(TK)promoterとluciferase遺伝子を含むplasmid に組込み、同様にNOと低酸素に対する反応性を調べたところ、HREを含む-986から-922の(HREを含む)範囲に両方の刺激に対する活性化のcis-elementsが存在することが分かった。さらにこの範囲に様々な変異を加え、その反応性を調べたところ、NOによる活性化のcis-elementsはHIF-1結合部位(HBS)とその直下のHIF-1 ancillary sequence(HAS)であった。その中心の塩基配列は、それぞれ(T)ACGTGとCAGGTであり、これらはimperfect inverted repeatを成していることが分かった。この両者間の塩基数を変えたところNOに対する反応性は消失したことから、HBSとHASは相互に協調してVEGFプロモーター活性化に関与していると考られた。また、HBSよりも約30塩基下流のactivator protein1(AP-1)部位の変異によってもNOに対する反応性が有意に低下した。同様に低酸素に対する反応性を調べたところ、全く同様の結果が得られたことからNOと低酸素による活性化のcis-elementはHBSとHASの2つであり、両者で全く共通していることが分かった。さらにこの両者の反応にはAP-1も促進的に関与していることが示唆された。 VEGF遺伝子の転写活性化因子の検索を行うために、SNAPまたは低酸素で処理されたA172細胞の核抽出物を用いて、electrophoretic mobility shift assay(EMSA)を行った。プローブとしてHBSを含むオリゴヌクレオチドを用いたところ、NO処理の細胞と低酸素処理の細胞のいずれの場合も同じ部位に2本のバンドが誘導された。ただし、低酸素の場合はこの2本とも強く誘導されたが、NOの場合は上方よりも下方のバンドのほうが強く誘導される傾向があった。competition assayを行ったところ、VEGFまたはerythropoietin(Epo)の野生型HBSを含むcompetitorを用いた場合にはNOで誘導されたbandsが2本とも消失したが、変異したHBSを含むcompetitorでは消失しなかった。低酸素の場合も同様であることから、NOによりHIF.1結合能が活性化されることが示唆された。HIF-1 プロモーターまたはエンハンサー領域にHREを有する低酸素誘導遺伝子には、VEGF,Epoや解糖系酵素の遺伝子などがあり、これらの転写にはHIF-1が関与していることが分かっている。これらの遺伝子のHREを調べたところ、その多くにHBSとHASからなる共通した構造があり、その両者の間の塩基数もほぼ一致していることが分かった。 以上の結果から次のことが明らかになった。 1.NOはVEGF遺伝子の転写を活性化するが、その至適濃度は周囲の酸素濃度に依存している。 2.NOによるVEGF遺伝子活性化のcis-elementsはHBSとその下流にあるHASであり、低酸素の場合と共通している。 3.NOは低酸素と同様にHIF-1活性化を通じてVEGF遺伝子の転写を活性化する。 4.多くの低酸素誘導遺伝子のHREにはHBSとHASからなる共通した構造がある。 NOが血管新生を促進するかどうかについては賛否両論があり、血管新生を抑制するという報告もある。これらの報告は用いる細胞やNO供与体の種類が異なるうえ、NOの影響は周囲の酸素濃度によって大きく左右されることから、一概にどちらが正しいか結論づけることはできない。しかし、我々の結果から低酸素によって誘導されたVEG遺伝子の転写活性化をNOがさらに増強することやVEGF遺伝子の転写因子として最も重要とされるHIF-1をNOが活性化していることから、NOが血管新生の制御に関与していることは間違いないと思われる。さらにHBSの下流にも新たなcis-elementであるHASがあり、何らかの蛋白がこの部位に結合し、HIF-1と協調して転写を活性化している可能性がある。NOによる転写活性はGC依存性ではないことが示唆されたが、低酸素の場合とは異なり、一部のGC阻害剤で抑制されることやEMSAで誘導されるバンドのパターンの相違からも低酸素とは異なる経路でHIF-1が活性化されると考えられる。 腫瘍内ではinducible NOSの発現が多く見られることから、NOによるVEGF遺伝子活性化の経路およびHASの役割を明らかにすることは腫瘍増大における血管新生の制御に役立つことと思われる。 | |
| 審査要旨 | 本研究は、腫瘍の血管新生において中心的役割を果たしていると考えられている血管内皮増殖因子(VEGF)の転写を一酸化窒素(NO)が制御するという知見に基づいて、その制御機構を明らかにするためにVEGF遺伝子promoter上のcis-elementsと転写活性化因子の同定を行ったものであり、下記の結果を得ている。 1.ヒトVEGF遺伝子promoterを含むluciferase発現ベクター(phVEGF1)をヒト神経膠芽腫(A-172)細胞または肝細胞癌(Hep3B)細胞に導入した。NO発生試薬(SNAP,NOC5)で細胞を処理した後に、その誘導性を調べたところ、NOは低酸素(1%酸素)と同様にVEGF遺伝子の転写を活性化することが分かった。さらに、NOによる誘導は低酸素の場合とは異なり、一部のguanylate cyclase(GC)阻害剤により抑制された。 2.phVEGF1のdeletion mutantsを用いて、NOと低酸素による誘導性を調べたところ、転写開始部位を起点に-1014から-794の範囲の欠損で誘導性は消失した。この範囲をthymidine kinase promoterとluciferase遺伝子を含むplasmidに組込み、同様に誘導性を調べると、-986から-922の(hypoxia response element,HREを含む)範囲に両方の刺激に対する活性化のcis-elementsが存在することが分かった。さらに細かい変異を加え、反応性を調べたところ、NOと低酸素による活性化のcis-elementsは、hypoxia inducible factor1結合部位(HIF-1 binding site;HBS)とその下流にあるHIF-1 ancillary sequence(HAS)の2つであり、AP-1部位も促進的に関与していることが分かった。HBSとHASの中心の塩基配列はそれぞれ(T)ACGTGとCAGGTであり、その両者間の塩基数を変えたところ、両方の刺激に対する反応性が消失したことから、HBSとHASは相互に協調してVEGFpromoter活性化に関与していることが示唆された。 3.NOまたは低酸素で処理されたA-172細胞の核抽出物とprobeとしてHBSを含むoligonucleotideを用いて、gel shift assayを行ったところ、いずれの場合も2本のバンドが同じ部位に誘導された。ただし、NOの場合と低酸素の場合とでは誘導されるバンドの濃度のパターンが異なっていた。competition assayからこれらの蛋白複合体はHBSに特異的に結合することが示唆され、HIF-1の抗体を用いたsupershift assayの結果からHIF-1のheterodimerを含むことが分かった。この結果から、NOは低酸素と同様にHIF-1活性化を通じてVEGF遺伝子の転写を誘導していることが分かった。 4.HREをpromoterまたはenhancer領域に有する低酸素誘導遺伝子の転写にはHIF-1が関与していることが分かっている。これらのHREの塩基配列を調べたところ、その多くにHBSとHASからなる共通した構造があり、その両者間の塩基数もほぼ一致していることが分かった。 以上、本論文はヒト腫瘍細胞を用いて、NOが低酸素と同様にHIF-1活性化を介して、VEGF遺伝子を誘導することを明らかにした。しかし、GC阻害剤に対する反応の違いやgel shift assayで誘導されるバンドのパターンの差から、NOは低酸素とは異なる経路でHIF-1を活性化する可能性が示唆された。本研究は、NOによるVEGF遺伝子の活性化におけるcis-elementsと転写活性化因子を明らかにすることで、腫瘍の血管新生のメカニズムの解明に重要な貢献をなすと考え、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54764 |
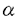 とHIF-1
とHIF-1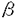 とのheterodimerからなり、どちらのサブユニットもbasic helix-loop-helix-per-amt-sim(bHLH-PAS)蛋白ファミリーに属する。HIF-1
とのheterodimerからなり、どちらのサブユニットもbasic helix-loop-helix-per-amt-sim(bHLH-PAS)蛋白ファミリーに属する。HIF-1