| 概論 8-Hydroxyguanine(以下8-OH-dG)は、酸素ラジカルによりグアニンが酸化されて生じた変異ヌクレオチドであり、DNA複製の際に、シトシンとほぼ同等にアデニンとも水素結合を形成するため、G:C→T:A遺伝子の突然変異をひき起こす可能性を持つと考えられている。8-OH-dGの修復酵素として、今までのところMutM、MutY、MutTが知られている。 このうち、MutM遺伝子のヒトホモローグは、1997年に我々のグループ(Aburatani et al.,1997:Can.Res.57:2151-2157)をはじめ、いくつかの報告があり同定されたが、その詳細な構造とヒトの発ガンとの関連においては報告されていなかった。この論文では、ヒトMutM homologueの詳細なグノム構造と、その染色体上の位置について示し、ヒトの癌細胞での遺伝子変異検索、多型性の検索を行い、エクソン1における多型性と肺がん発生との関連について検討した。 材料と方法詳細なゲノム構造と染色体上の位置の決定使用したクローンと3’端の解析 ヒトBACライブラリーを、hMutM遺伝子の既知の塩基配列の相同部分に設計したプライマーでPCRを行った。ポジティブなクローン(hMMH/OGG1遺伝子を含むと考えられるクローン)を同定し、制限酵素で切断したのちサブクローニングした。サブクローンを再び、相同部分のプライマーを用いるPCRにでスクリーニングしクローニングするクローンを決定した。エクソン1とエクソン7、エクソン7とエクソン8で、それぞれプライマーを設計し、20kbPLUSsystem(Boehringer Mannheim)を用いてPCRを施行した。このDNAをテンプレートとして、必要に応じPCRにて増幅、サブクローニングを行った。最初はエクソンの塩基配列よりエクソン内にプライマーを決定した。walking法によりプライマーをデザインしイントロン内のシークエンシングを順々に行った。 5’端の上流領域についてはヴェクトレットPCR法を用い増幅した。増幅された産物をサプクローニングした後、エクソン1側から順にwalking法によりプライマーをデザインしシークエンスを行った。得られた塩基配列に対し、3’端の塩基配列についてGenbankのデーターベースから、BLAST searchを用いて検討した。 Primer extension analysisと上流領域の解析 A549(肺癌)、Lu-130(肺癌)、GT3TKB(胃癌)の3種類の細胞株から得られたRNAを用いて、primer extension analysisを行った。エクソン1に5’端方向のプライマーを設計し、[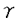 -32P]ATPで標識した。RT-PCRを行い、8M尿素を含むポリアクリルアミドゲルで泳動した。GenBankのデータベースを用いてBLASTサーチを行った。転写因子の解析に関しては、TFSEARCHプログラムを使用して解析した -32P]ATPで標識した。RT-PCRを行い、8M尿素を含むポリアクリルアミドゲルで泳動した。GenBankのデータベースを用いてBLASTサーチを行った。転写因子の解析に関しては、TFSEARCHプログラムを使用して解析した Radiation hybrid panel mapping エクソン3に設計したプライマーを用い、GeneBridge4 panelにてradiation hybrid cellをタイピングした。その結果を、Whitehead Institute/MIT Centerのサーバーを用いて、フレームワークマップ上にマッピングした。 癌細胞と臨床検体における変異の検討 癌細胞株51例、肺癌40例、胃癌25例、肝細胞癌40例、腎細胞癌67例を用いて検討した。それぞれからDNAを抽出しPCR-SSCP(Single Strand Comformation Polymorphism)法で検討した。第1エクソンから第7エクソンすべてを検討した。PCR-SSCP法で変異の見られた産物はシークエンシングにて塩基配列を決定した。 肺癌患者におけるエクソン1における多型性の頻度と発癌との関係の検討 PCR-SSCPでみられたエクソン1における3種類のアレルをサプクローニング後シークエンスを決定した。健常人群と肺癌患者群とで、アレルの頻度を比較検討した。検討において、SASシステムを用いロジスティック解析を行った。 結果 hMMH/OGG1遺伝子は7つのエクソンからなり、その全長は7421bpであった。4つのアイソフォーム(アイソフォーム1a-cおよび2)がみとめられた。アイソフォーム1aがcommon typeで、1bはイントロン6をスプライシングしないもの、1cはイントロン6の最後の17bpを含むものであった。アイソフォーム2はalternative splicingによりエクソン7をスプライシングし、約9kbの第7イントロンの下流のエクソン8を使用する構造であった。3’端はCaMK1遺伝子と重なっていたが、ポリA付加シグナルを含む55bpは、ラットおよびマウスのOGG1遺伝子と、ヒトおよびラットのCaMK1遺伝子において完全に保存されていた。上流領域については5’端の約1kbを検討した。-30bp付近にはTATAAA elementはみられず、-948bpまでの範囲内に存在する転写因子結合ドメインを検索した。-500bpまでのGC含有率は63.2%であった。Primer extension法にて転写開始点は、翻訳開始点より318bp上流であることが確認された。染色体上の位置は、従来3p24付近と報告されていたが、Radiation hybrid panel mapping法によって、WI-4179(染色体マーカー)より3.87cRほどセントロメティックと考えられた。また、この位置はVon Hippel-Lindau遺伝子(以下VHL遺伝子)とごく近傍であった。 細胞株2種類において遺伝子の点突然変異をみとめた。臨床検体においては点突然変異はみられず4ケ所で多型性をみとめたのみであった。 エクソン1における非翻訳領域の2種類の多型性と肺癌との関連においては、エクソン1における多型性の1種類(アレルタイブ3)が肺腺癌との有意な関連性がみられた(p-value 0.0292、odds ratio 2.597)。 考察 8-hydroxyguanine glycosylaseをエンコードするゲノムDNAの完全長をシークエンシングし、そのアイソフォームの同定、遺伝子の上流域の解析、CaMK1遺伝子との重複領域の解析、染色体上の詳細な位置決定を行った。 アイソフォームは4種類存在し、その詳細な構造も決定できたが、局在をはじめとするアイソフォームの意義などは今後の検討が必要と思われる。上流領域はTATAAA elementを認めずGC-contentも高く、いわゆる「housekeeping遺伝子」であると考えられた。3’末端のCaMK1遺伝子との重複部分について、55bpがヒトのみならず、ラットやマウスでも完全に保存されていた。この部分がhMMH/OGG1遺伝子およびCaMK1遺伝子両方のポリA付加に必要であるためと考えられる。 PCR-SSCP法を用いた解析で、突然変異をみとめたのは癌細胞株の2例のみであった。この遺伝子の突然変異の頻度は高くないと思われる。その一方多変量解析でhMMH/OGG1遺伝子が肺腺癌と関連がある可能性が示唆された。この領域は非翻訳領域であり直接的にアミノ酸の変異などは起こさないが、発現調節により発癌と関与している可能性は考えられる。また、この多型性がより上流との関連で発癌に関与している可能性も考えられる。今回の遺伝子がYAC上に存在していなかったことも興味深い。遺伝子の組み換えなどの可能性が考えられる。イントロン内に存在したAlu配列の存在も、この領域の組み換えなどの変異の起きやすさとの関連をうかがわせる。この遺伝子は染色体3番の短腕に存在し、LOHの存在もよく報告される領域である。WHL遺伝子の極めて近傍に位置していたことも含め、興味深いと思われる。今後、この遺伝子および3p24領域の発癌との関連について、さらなる検討が必要と考えられる。 結論 この論文においてhMMH/OGG1遺伝子の詳細なゲノム構造と染色体上の位置を示し、癌細胞における変異を検討し、日本人におけるエクソン1の多型性と肺腺癌の関連のリスク評価を行った。 ゲノムDNAの完全長をシークエンスしGenBankに登録した。アイソフォームは4種類存在した。上流領域の検索でこの遺伝子が「housekeeping遺伝子」であった。3’端の検討で、CaMK1遺伝子とのポリA付加領域の保存が確認された。 癌細胞における変異の頻度は高くないと考えられたが、エクソン1における多型性と肺腺癌との間で関連性がある可能性が示唆された。 多型性と発癌の関連とこの遺伝子の存在する3p24領域の今後のさらなる検討が必要である。 |