各々の器官を構成する細胞は、その細胞数を一定に保つために、増殖を促進する因子と抑制する因子とによって制御を受けている。TGF-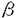 (transforming growth factor- (transforming growth factor-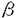 )は細胞増殖抑制活性をもつ代表的な生体分子であり、アクチビン、BMP(bone morphogenetic protein)などとともにTGF- )は細胞増殖抑制活性をもつ代表的な生体分子であり、アクチビン、BMP(bone morphogenetic protein)などとともにTGF-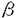 スーパーファミリーを形成している。TGF- スーパーファミリーを形成している。TGF-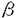 スーパーファミリーに属する因子は細胞増殖調節作用の他に、細胞の分化、アポトーシス、細胞外マトリックスの産生の制御などにも関わりを持っており、このファミリーが多細胞個体の形態形成や創傷治癒などの中心的な調節因子のひとつであることが知られるようになった。また、多くの癌細胞では悪性度が増す過程で、TGF- スーパーファミリーに属する因子は細胞増殖調節作用の他に、細胞の分化、アポトーシス、細胞外マトリックスの産生の制御などにも関わりを持っており、このファミリーが多細胞個体の形態形成や創傷治癒などの中心的な調節因子のひとつであることが知られるようになった。また、多くの癌細胞では悪性度が増す過程で、TGF-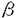 による増殖抑制を受けなくなることが知られており、TGF- による増殖抑制を受けなくなることが知られており、TGF-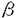 シグナルの異常と癌化との関連が注目されている。 シグナルの異常と癌化との関連が注目されている。 TGF-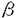 スーパーファミリーは、2種類のセリン-スレオニンキナーゼ型レセプター(I型とII型)を介してそのシグナルを伝える。レセプターが活性化されると細胞質内に存在するSmadと呼ばれる一連の蛋白質がレセプターに結合して活性化される。TGF- スーパーファミリーは、2種類のセリン-スレオニンキナーゼ型レセプター(I型とII型)を介してそのシグナルを伝える。レセプターが活性化されると細胞質内に存在するSmadと呼ばれる一連の蛋白質がレセプターに結合して活性化される。TGF-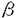 スーパーファミリーのシグナルは、Smad以外の分子によって伝達される経路も知られているが、Smadを介して細胞の核へと伝達される経路によって多くの反応が誘導されている。現在、哺乳類では8種類のSmadファミリー分子の存在(Smad1〜Smad8)が知られているが、この中でSmad2は、TGF- スーパーファミリーのシグナルは、Smad以外の分子によって伝達される経路も知られているが、Smadを介して細胞の核へと伝達される経路によって多くの反応が誘導されている。現在、哺乳類では8種類のSmadファミリー分子の存在(Smad1〜Smad8)が知られているが、この中でSmad2は、TGF-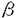 とアクチビンのシグナルに特異的で、TGF- とアクチビンのシグナルに特異的で、TGF-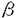 のシグナル伝達経路を考える上で重要な役割を果たしている。 のシグナル伝達経路を考える上で重要な役割を果たしている。 TGF-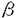 の細胞内シグナル伝達機構におけるSmadファミリーの役割はいまだ解明されていない点も多く、SmadのなかにはTGF- の細胞内シグナル伝達機構におけるSmadファミリーの役割はいまだ解明されていない点も多く、SmadのなかにはTGF-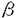 のシグナル伝達と癌抑制機構を関連づける重要な物質と考えられるものが存在する。Smad4(またはDPC4)は膵臓癌の癌抑制遺伝子として発見されたもので、Smad2と協調してTGF- のシグナル伝達と癌抑制機構を関連づける重要な物質と考えられるものが存在する。Smad4(またはDPC4)は膵臓癌の癌抑制遺伝子として発見されたもので、Smad2と協調してTGF-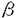 のシグナルを伝達する。Smad4はヒトでは染色体18q21.1に存在し、膵臓癌の約半数において、変異の存在が報告されており、その他の癌においても変異が報告されている。一方、Smad2は、18q21.1に存在することが知られている。Smad2でも頻度は少ないながらも大腸癌、肺癌で変異が報告されている。 のシグナルを伝達する。Smad4はヒトでは染色体18q21.1に存在し、膵臓癌の約半数において、変異の存在が報告されており、その他の癌においても変異が報告されている。一方、Smad2は、18q21.1に存在することが知られている。Smad2でも頻度は少ないながらも大腸癌、肺癌で変異が報告されている。 今回、癌における変異が報告されているSmad2のもつ機能を調べるために、Smad2欠損マウスを作成し、生体内における機能の解析を行ない、さらにAPC欠損マウスとの交配によって消化管腫瘍の発生における役割について解析した。 1.Smad2欠損マウスの作成 マウスSmad2cDNAの全長より、転写開始部位を含むDNA断片を制限酵素で切断し、これをプローブとしてA129/Svマウスジェノミックライブラリーのスクリーニングをおこなった。得られた複数のクローンを用いてexon3,exon4を含む標的遺伝子の制限酵素地図を作成の後、変異導入の部位を決定し、2種類のターゲティングベクターを設計し、作成した。電気穿孔法を用いてES細胞にターゲティングベクターを導入し、変異ES細胞を選別した後にそれを単離し、サザンブロット法を用いて、相同組換えのほかに非相同組換えがないクローンを選別し、C57BL/6マウスのブラストシストへ注入してキメラマウスを作成した。得られたキメラマウスとC57BL/6マウスを交配しF1を作成、PCR法にて解析し、生殖細胞系列へ変異の伝達を確認した。 2.Smad2欠損マウスの解析 Smad2欠損マウスの解析は、(Nomura.&Li,1998)をはじめいくつかが既に報告されており、ホモ接合体は胎生7.5日で中胚葉の形成が行われずに致死となることがわかっている。今回、Smad2のホモ接合体の中胚葉形成異常を更に詳しく調べるために、brachyury、HNF4、Hexをマーカー遺伝子としてRNAプローブを作成し、致死となる時期の胎児のホールマウントin situハイブリダイゼーションを行った。正常マウスでは、胎生6.5日目に胚盤葉上層の後端に原条と呼ばれる溝が生じ、原腸陥入が始まる。まず最初に原腸陥入開始1日後の胎生7.5日の胚を摘出し、brachyuryをプローブとして実験を行った。brachyuryは早期中胚葉細胞と原条に発現が見られる遺伝子である。Smad2のホモ接合体欠損マウスではbrachyuryの発現が全く認められず、ヘテロ接合体では野生型と比較して、発現がやや弱く伸長が不十分であった。このことより、ホモ接合体では原条形成も中胚葉細胞も誘導されておらず、ヘテロ接合体の発現結果より、Smad2遺伝子の発現量に依存してbrachyuryの発現が見られることが示唆された。HNF4は、臓側内胚葉に発現する初期のマーカーとして用いたが、胎生7.5日では野生型、ヘテロ接合体の間では発現に差がなかったが、ホモ接合体には発現が認められなかった。このことより、臓側内胚葉もホモ接合体では正常に作られていないことが証明された。Hexは臓側内胚葉のなかでも胎児の前側に発現するもので、原腸陥入の前に前後軸が決定することを見ることができるのだが、胎生6.5日ホモ接合体ではこれも発現が認めらなかった。したがって、ホモ接合体はすでに報告されたように中胚葉の形成がなされず全例が致死となるが、中胚葉の形成以前の内胚葉での異常により、前後軸が決定されないため原条も中胚葉も形成されないことが示唆された。 ヘテロ接合体は一部に単眼症や顔面の奇形を生じるものもあるが、多くは正常に発育し、現在1年11カ月まで経過観察しているが、外見上正常で野生型との区別はなく、癌の発生などは認めていない。 3.Smad2ヘテロ接合体とAPCヘテロ接合体の交配による消化管腫瘍の解析 APC(adenomatous polyposis coli protein)遺伝子はFAP(家族性大腸腺腫症)の原因遺伝子として発見されたものであり、FAP患者では正常な大腸上皮細胞で相同染色体の双方のAPC遺伝子に変異が生じると良性腺腫が多発する。APCヘテロマウスでも、ヒトと同様に消化管にポリポーシスを生じるが、Smad2ヘテロマウスではSmad4ヘテロマウスと同様に腫瘍の発生を認めなかった。マウスではAPC遺伝子もSmad2,Smad4と同じ、18染色体長腕に存在し、Smad2やSmad4のヘテロマウスでもAPCヘテロマウスと同様の頻度でそれぞれの遺伝子のホモ接合変異を起こしていると考えられる。それにもかかわらず、どちらもそれぞれの遺伝子の単独の欠損だけでは消化管ポリープの発生は認めていない。TGF-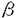 は増殖抑制活性をもち、そのシグナルに異常を生じると増殖が過剰になって腫瘍が発生すると考えられていたが、Smad2やSmad4の異常だけでは腺腫は発生しないことを意味する。 は増殖抑制活性をもち、そのシグナルに異常を生じると増殖が過剰になって腫瘍が発生すると考えられていたが、Smad2やSmad4の異常だけでは腺腫は発生しないことを意味する。 一方、Smad4とAPC遺伝子が同じ18番染色体上に存在することから減数分裂の際に生じる相同組み換えを利用して、同一染色体に両方の欠損を持つSmad4/APCシス複合変異ヘテロマウスを作成すると、消化管ポリープの悪性化を生じるという報告がなされた。Smad2もSmad4と同様にAPCと同じ18番染色体に存在するので、私たちはSmad2欠損マウスをSmad4のかわりに用いて、同様の実験を行ない、生じる腫瘍について調べた。 コドン580にフレームシフト変異のあるAPCヘテロマウスとSmad2ヘテロ結合体マウスを交配し得られたSmad2/APC-トランス複合変異ヘテロマウスを野生型マウスに戻し交配すると、減数分裂時に生じる組換えにより同一染色体上に両方の欠失変異を持つマウス(シス複合変異ヘテロマウス)が生まれてくる。シス複合変異ヘテロマウスと、APCヘテロマウスはどちらも消化管に腫瘍を多数認めるが、これら2種類のマウスの消化管腫瘍の分布、個数、直径を調べた。その結果、腫瘍全体の分布、個数に関しては2種類のマウスで大きな差はなかったが、4mm以上の直径の大きな腫瘍の個数はシス複合変異ヘテロマウスに多く認められた。また、APCヘテロ接合体マウスは貧血や栄養状態の悪化をきたして衰弱死するものが多いのに対し、シス複合変異ヘテロマウスでは腫瘍の増大により、腸閉塞を発生して突然死する個体が多く、APC異常によって発生した腺腫にSmad2異常が加わることによって、個体の予後を左右する程、腫瘍の発育が促進されることが示された。さらに、同じ週令の同一部位の小腸上部の腫瘍組織をHE染色にて組織学的に比較検討したところ、APCヘテロマウスのポリープは腺管構造が保たれており、間質の増生も軽度で良性腺腫の像を呈するのに対し、シス複合変異ヘテロマウスの場合は、多くの腫瘍に腺管構造の破壊と柵状配列、核の異型、N/C比の増大、間質の増生に加え、APCヘテロマウスでは見ることのなかった筋層への浸潤、脈管への浸潤などの明らかな悪性所見を認めた。ただし、現在のところ、遠隔転移や他の臓器における癌の発生は認めていない。 これらの実験結果により、Smad2は胎生初期の発生に重要であり、その中でも前後軸の決定とそれにひきつづく原腸陥入、中胚葉の誘導に必須であることが示された。また、APCとのシス複合変異ヘテロマウスの消化管腫瘍を解析することにより、癌化との関わりが示唆されていたSmad2が実際に腫瘍の悪性化過程を抑制する癌抑制遺伝子として機能していることを示すことができた。 |