学位論文要旨
| No | 115462 | |
| 著者(漢字) | 中川,匠 | |
| 著者(英字) | ||
| 著者(カナ) | ナカガワ,タクミ | |
| 標題(和) | アデノウイルスベクターを用いたcsk遺伝子導入による大腸癌細胞の肺転移抑制 | |
| 標題(洋) | ||
| 報告番号 | 115462 | |
| 報告番号 | 甲15462 | |
| 学位授与日 | 2000.03.29 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第1648号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 外科学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | がんの治療成績を支配する重要な因子のひとつは転移と言われている。したがって、転移を制御することができれば治療成績が格段に向上することが期待できる。がんの転移のプロセスは、原発部位からの癌細胞の遊離、脈管・リンパ管を介しての移動、標的臓器への接着・浸潤、さらに増殖が関与する複雑な現象である。この複雑な現象を解明するため細胞生物学的手法が取り入れられ、1973年、Fidlerによって高転移性の細胞株が分離された。高転移性株を用いた細胞生物学的な研究、さらに生化学的な研究が活発に行われ、転移の研究は近年めざましい進展をとげつつある。 ラウス肉腫より同定されたがん遺伝子であるv-srcの正常細胞におけるcounterpartである、がん原遺伝子であるc-srcはそれ自身には細胞をトランスフォームする能力はないが、大腸癌、乳癌をはじめとした様々ながん組織でその発現が上昇していることが、以前より知られている。c-Srcは細胞膜の内側に局在するチロシンキナーゼファミリーの一つであり、増殖因子受容体として細胞の増殖、分化、免疫応答などの多様な生命現象に深く関与している。c-Srcの発現上昇は大腸癌組織においてはもっとも詳細に検討されており、大腸ポリープに比べがん組織ではそのキナーゼ活性が上昇していること、また大腸癌原発巣よりも転移部位においてそのキナーゼ活性がきわめて高いことが判明し、病期との関連が指摘されている。また最近、大腸癌高転移性細胞株では低転移性細胞株に比べてc-Srcのチロシンキナーゼ活性が上昇していることが報告された。したがって、c-Srcの活性を抑制することにより大腸癌の転移を制御できる可能性があると考えられる。 Srcファミリーチロシンキナーゼの活性はそのSH-2領域とC末に存在する527番目のリン酸化したチロシン残基との分子内結合により規定されている。すなわち、527番目のチロシン残基がリン酸化しているときは、SH-2領域とチロシン残基との間で分子内結合しそのキナーゼ活性は抑制されている。一方、527番目のチロシン残基が脱リン酸化しているときは、この分子内結合はおこらずそのキナーゼ活性は活性化している。Csk(C-terminal Src kinase)はSrcファミリーチロシンキナーゼの活性を抑制するチロシンキナーゼとして同定されたチロシンキナーゼであり、SrcファミリーのC末に存在するチロシン残基をリン酸化することにより、そのチロシンキナーゼをネガティブに制御することが知られている。本研究では、アデノウィルスベクターを用いてSrcのnegative regulatorであるcsk遺伝子を大腸癌高転移性細胞株に遺伝子導入することにより、その転移を制御できるかどうか検討した。 転移能の評価には、マウス結腸癌細胞colon adenocarcinoma26より、Fidlerの方法に従い選択された高転移性癌細胞株であるNL-17細胞を用いた実験的転移の系を用いた。NL-17細胞をBALB/cマウスの尾静脈に静注すると、2〜3週後肺に多数の転移性結節を再現性よく形成する。まずNL-17細胞にアデノウィルスが効率よく感染するかどうか、LacZ遺伝子が組み込まれたアデノウィルスを用いて検討したところ、MOI300で95%以上の細胞で 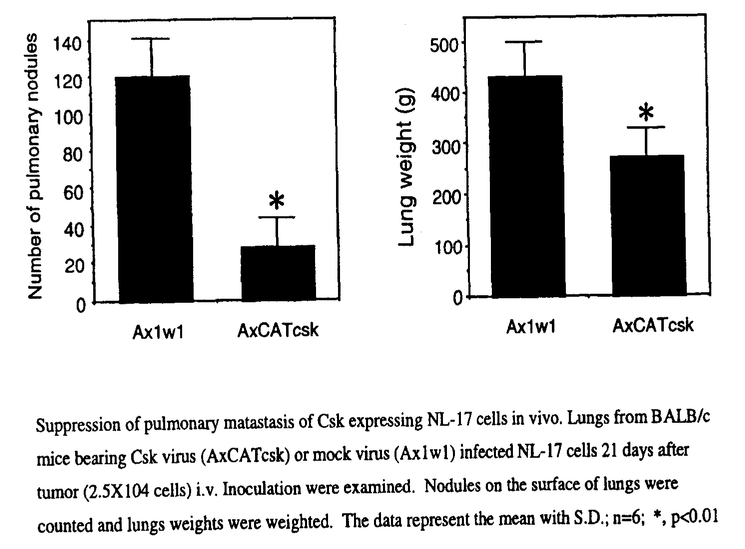 さらにこのin vivoにおける肺転移形成の差を説明するメカニズムをin vitroで検討した。Srcファミリーのタンパク質は、細胞の増殖以外にその接着にも関与していると報告されている。そこで、Cskの過剰発現ががん細胞の運動性に影響をおよぼしているのではないかと考え、トランスウェル・チャンバーを用いてフィブロネクチンに対するケモタキシスの差を比較した。しかしながら予想に反して、2つのウィルスを感染させた細胞間でフィブロネクチンに対する走化性の違いは観察されながった。そこで、in vitroにおいて再構成した基底膜であるマトリゲルを浸潤する能力、すなわちケモインベージョンの違いを検討した。Cskウィルスを感染させたNL-17細胞では、mockウィルスを感染させたNL-17細胞に比べて、マトリゲルをコートした膜を通過した細胞は著明に減少していた。ゼラチンモグラム法により、培養上清中に産生されるMMP(マトリックス・メタロプロテアーゼ)を定量的に検討したところ、Cskウィルスを感染させたNL-17細胞では活性型MMP-2(gelatinase A)の減少が観察された。一方、活性型MMP-2の前駆体であるProMMP-2(Progelatinase A)の産生量には変化がなかった。したがって、Cskの過剰発現はNL-17細胞のMMP-2の活性化機構を抑制していると考えられた。がん細胞のMMP-2の活性化には、MT-MMP(膜型マトリックス・メタロプロテアーゼ)が関与しているとされており、Cskの過剰発現によるSrcキナーゼの活性の抑制がMT-MMPなどのMMP-2の活性化分子の発現を抑制している可能性が示唆された。 以上の実験から、マウス大腸がん高転移株にcsk遺伝子を導入することによりその実験的肺転移を抑制できることを見いだした。実際に遺伝子治療への応用を考えた場合、大量のアデノウィルスを直接人体に投今した場合、アデノウィルス由来の遺伝子が少量発現するため細胞性免疫反応を引き起こすこと、またがん細胞以外の正常細胞にも感染してしまうといった特異性などの問題点が現在のところ存在する。しかしながら、アデノウィルスには生体内で固形がんをはじめとした、多くの種類の細胞に感染することができ、目的の遺伝子を効率よく導入できるという長所がある。また、CEAなどの悪性腫瘍に特異的に発現しているタンパク質に反応するプロモーターを組み込まれたアデノウィルスベクターを用いた、癌特異的遺伝子治療の開発が進んでいる。したがって、将来様々なアプローチからの研究が展開し、これらの問題点が解決されたならば、アデノウィルスベクターを用いたcsk遺伝子の導入は大腸癌の転移の阻止に有望な一つの手段であると考えられる。さらに本研究の結果から考えると、特異性が高く毒性の低いSrc阻害剤、MMP阻害剤も大腸癌の転移の阻止に有望であり、これらの新しい薬剤の開発が待たれるところである。 | |
| 審査要旨 | 本研究はがんの転移において重要な役割を演じていると考えられているチロシンキナーゼc-Srcの活性をアデノウィルスベクターを用いてcsk遺伝子を導入することにより抑制し、そのがん細胞の転移能に与える影響をマウス結腸癌高転移株を用いた実験的転移系を用いて解析を試みたものであり、下記の結果を得ている。 1.マウス結腸がん細胞colon adenocarcinoma26由来高転移株NL-17細胞にアデノウィルスベクターを用いて高率に目的の遺伝子を導入できることを、lacZ遺伝子が組み込まれたアデノウィルスベクターを感染させた後に、 2.csk遺伝子が組み込まれたアデノウィルスベクターを感染させたNL-17細胞をBalb/cマウスに尾静注し、肺に形成する転移性結節数、肺重量によりその転移能を検討したところ、コントロールのmockのアデノウィルスベクターを感染させたNL-17細胞と比較して、肺に形成する転移性結節数、肺重量が著明に減少することが示された。 3.csk遺伝子を導入したNL-17細胞のfibronectinに対する走化性をトランスウェルチャンバーを用いて検討したところ、コントロールNL-17細胞と比較して差は観察されなかった。一方、浸潤能をマトリゲルがコートされたボィデンチャンバーを用いて検討したところ、csk遺伝子を導入したNL-17細胞においてその浸潤能の低下が観察された。細胞の培養上清中のマトリックスメタリプロテアーゼの産生量を、ゼラチンザィモグラム法により検討したところ、csk遺伝子を導入したNL-17細胞において活性型MMP-2の産生が減少していることが確認された。Balb/cマウスの背部にcsk遺伝子を導入したNL-17細胞を皮下移植して、その浸潤能を検討したところ、コントロールNL-17細胞と比較してその浸潤能の低下が観察された。 以上、本論文はマウス結腸がん由来高転移株NL-17細胞にcsk遺伝子を導入することにより、実験的肺転移が著明に抑制される事実を明らかにした。これまでがんの転移の抑制にcsk遺伝子を応用した研究は内外に存在せず、十分に新しい知見であると考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54125 |
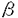 -gal活性が陽性であった。cskウィルスを感染させて48時間培養した後回収した細胞では、cskウィルスの感染量依存的なCskのタンパク質発現の上昇がウェスタンブロッティング法で確認された。Srcのチロシンキナーゼを抗Src抗体を用いた免疫沈降物によるin vitro kinase反応により評価したところ、Cskのタンパク質の発現上昇に伴いSrcのチロシンキナーゼ活性が抑制されるのが観察された。さらにCskを高発現させたNL-17細胞をBALB/cマウスの尾静脈に静注して、3週後にマウスを剖検してその肺を調べたとろ、mockウィルスを感染させたNL-17細胞をi.v.投与したcontrol群に比べ、Csk群では肺の転移性結節の形成が著明に減少していた。肺の表面の結節数および肺重量を調べたところ、結節数、重量ともCsk群において有意に減少していた(表;n=6)。
-gal活性が陽性であった。cskウィルスを感染させて48時間培養した後回収した細胞では、cskウィルスの感染量依存的なCskのタンパク質発現の上昇がウェスタンブロッティング法で確認された。Srcのチロシンキナーゼを抗Src抗体を用いた免疫沈降物によるin vitro kinase反応により評価したところ、Cskのタンパク質の発現上昇に伴いSrcのチロシンキナーゼ活性が抑制されるのが観察された。さらにCskを高発現させたNL-17細胞をBALB/cマウスの尾静脈に静注して、3週後にマウスを剖検してその肺を調べたとろ、mockウィルスを感染させたNL-17細胞をi.v.投与したcontrol群に比べ、Csk群では肺の転移性結節の形成が著明に減少していた。肺の表面の結節数および肺重量を調べたところ、結節数、重量ともCsk群において有意に減少していた(表;n=6)。